
| A. | 150mL1mol•L-1的NaCl溶液 | B. | 75mL4mol•L-1的NH4Cl溶液 | ||
| C. | 75mL1mol•L-1的FeCl3溶液 | D. | 150mL2mol•L-1的KCl溶液 |
分析 50mL1mol/L的AlCl3溶液中的Cl-浓度为3mol/L,根据溶质化学式计算各选项中的Cl-物质的量,进行比较可知.注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.
解答 解:50mL1mol/L的AlCl3溶液中的Cl-浓度为3mol/L.
A、150ml1mol/L的NaCl溶液中Cl-浓度为1mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度不相等,故A不符合;
B、75mL4mol•L-1的NH4Cl溶液中Cl-浓度为4mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度不相等,故B不符合;
C、75mL1mol•L-1的FeCl3溶液溶液中Cl-浓度为3mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度相等,故C符合;
D、150m2mol/L的KCl溶液中Cl-浓度为2mol/L,与50mL1mol/L的AlCl3溶液中的Cl-浓度不相等,故D不符合.
故选C.
点评 本题考查物质的量浓度的计算与理解,题目难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质组成 | 甲 | 乙 | 丙 | 丁 |
| 各元素原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
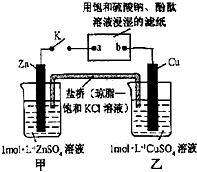
| A. | Cu电极上发生还原反应 | B. | 电子沿Zn→a→b→Cu路径流动 | ||
| C. | 片刻后甲池中c(SO42-)增大 | D. | 片刻后可观察到滤纸b点变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 | B. | 15 | C. | 25 | D. | 16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、Br-、Ba2+ | B. | Na+、SO32-、SO42-、K+ | ||
| C. | K+、MnO4-、NO3-、Na+ | D. | K+、Ca2+、SO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
周期 主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ④ | |||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
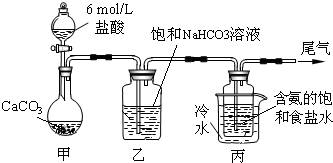
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com