
【题目】乙酸乙酯是重要的有机物。某化学兴趣小组对乙酸乙酯的制取进行探究活动。
[查阅资料]乙酸乙酯:无色、有芬芳气味的液体,沸点77℃,熔点-83.6℃,密度0.901g/cm3,溶于乙醇、氯仿、乙醚和苯等,微溶于水,在饱和碳酸钠中溶液溶解度更小,比水轻。

[反应原理]
CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
[实验探究]某化学兴趣小组设计如图装置进行实验。在大试管a内加入碎瓷片后,加入10mL乙醇,边振荡边加入5mL98%的浓H2SO4,冷却后再加入8mL冰醋酸,点燃酒精灯缓慢加热,将产生的蒸气经导管通入到试管b中的的饱和Na2CO3溶液的液面上,观察现象。
[问题讨论]
(1)试管a内加入碎瓷片的作用_______(填“防止暴沸”或“防止倒吸”);
(2)试管b中长导管没有伸入饱和Na2CO3溶液的原因是_______(填“防止暴沸”或“防止倒吸”);
(3)实验中饱和碳酸钠溶液的作用是_______________;
A.中和乙酸和乙醇
B.加速酯的生成,提高其产率
C.溶解乙醇,中和乙酸,降低乙酸乙酯的溶解,有利于分层析出。
(4)反应结束后试管b中的现象是_______;
A.溶液不分层
B.溶液分层,无色油状液体在上层
C.溶液分层,无色油状液体在下层
(5)若用9.2g乙醇与足量的冰醋酸反应,分离得到纯乙酸乙酯13.2g,反应的产率是________。
【答案】防止暴沸 防止倒吸 C B 75.0%
【解析】
(1)碎瓷片有许多小孔,每一个小孔都是一个沸腾中心;
(2)乙酸乙酯中含有乙醇和乙酸,二者都是与水互溶的,易引起倒吸。
(3)饱和碳酸钠能够吸收未反应的乙醇、乙酸,且乙酸乙酯在饱和碳酸钠溶液中的溶解度较小;
(4)乙酸乙酯是难溶于水、密度比水小、有香味的油状液体;
(5)根据乙醇的质量计算乙酸乙酯的理论产量,产率=![]() ×100%。
×100%。
(1)碎瓷片有许多小孔,每一个小孔都是一个沸腾中心,试管a内加入碎瓷片的作用是防止暴沸;
(2)乙酸乙酯蒸气中含有乙醇和乙酸,二者都是与水互溶的,易引起倒吸,所以试管b中的导管不插入液面下的原因是防止倒吸。
(3)试管b中饱和Na2CO3的作用是①中和乙酸,② 溶解乙醇,③降低酯在水中的溶解度,有利于分层析出,故选C;
(4)乙酸乙酯是难溶于水、密度比水小、有香味的油状液体,反应完毕后,振荡试管b,观察到的现象是溶液分层,上层是无色油状有香味的液体,选B;
(5)设9.2g乙醇生成乙酸乙酯的理论产量是xg,
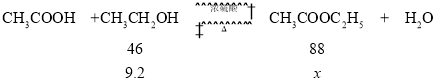
![]() =
=![]() ,解得x=17.6,产率=
,解得x=17.6,产率=![]() ×100%=75%。
×100%=75%。


科目:高中化学 来源: 题型:
【题目】氨氮是水体中氮的主要形态之一,氨氮含量过高对水中生物会构成安全威胁。
(1)一定条件下,水中的氨氮可以转化为氮气而除去。
已知:2NH4+(aq)+3O2(g)=2NO2-(aq)+2H2O(l)+4H+(aq) ΔH=a kJ·mol-1
2NO2-(aq)+O2(g)=2NO3-(aq) ΔH=b kJ·mol-1
5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH=c kJ·mol-1
则4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) ΔH=________kJ·mol-1。
(2)实验室用电解法模拟处理氨氮废水。电解时,不同氯离子浓度对溶液中剩余氨氮浓度的影响如图所示。增大氯离子浓度可使氨氮去除率____(填“增大”、“减小”或“不变”),其原因是阳极生成强氧化性气体,则阳极电极反应为_______。

(3)化学沉淀法是一种处理高浓度氨氮废水的有效方法。通过加入MgCl2和Na2HPO4将NH4+转化为MgNH4PO4·6H2O沉淀除去。25 ℃时,在氨氮初始质量浓度400 mg·L-1、n(Mg)∶n(P)∶n(N)=1∶1∶1的条件下,溶液pH对氨氮去除率及剩余氨氮浓度和总磷浓度的影响如图所示。
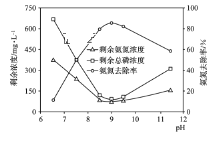
①反应生成MgNH4PO4·6H2O沉淀的离子方程式为______________。
②该实验条件下,控制溶液的适宜pH范围为________;当pH>9时,溶液中总磷浓度随pH增大而增大的主要原因是_________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年夏季奥运会将在“足球王国”——巴西首都里约热内卢举行,下图酷似奥林匹克旗中的五环的一种有机物被称为奥林匹克烃,下列说法中正确的是( )
![]()
A.该有机物属于芳香族化合物,是苯的同系物
B.该有机物是只含非极性键的非极性分子
C.该有机物的一氯代物只有一种
D.该有机物完全燃烧生成H2O的物质的量小于CO2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中只存在OH-、H+、Na+、CH3COO-四种离子,试回答下列问题:
(1)若溶液中只溶解了一种溶质,则该溶质是___________,溶液中c(H+)_____c(OH-)(填“>”、“=”或“<”)。
(2)若溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则该溶液中的溶质为_____________,若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则该溶液中溶质为_________________。
(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,且恰好呈中性,则混合前c(NaOH)__________c(CH3COOH),混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)__________c(H+)(填“>”,“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】
绿柱石被国际珠宝界公认为四大名贵宝石之一。主要成分为Be3Al2[Si6O18],因含适量的Cr2O3(0.15~0.6%),而形成祖母绿。试回答下列问题:
(1)基态Al原子中,电子填充的最高能级是_______,基态Cr原子的价电子排布式是_____。
(2)用“>”或“<”填空:
第一电离能 | 键能 | 沸点 | 离子半径 |
Be_____B | C—C_____Si—Si | H2S_____H2O | Al3+_____O2- |
(3)BeCl2分子的空间构型是______,它的二聚体Be2Cl4结构如右图所示,其中Be原子的杂化方式是_____。
![]()

(4)强还原剂LiAlH4能将SiCl4还原成SiH4,试写出SiH4在空气中自燃的化学方程式______。
(5)Be的氧化物的立方晶胞结构如右图所示,已知氧化铍晶体的密度为ρg·cm-3,则晶胞连长为___cm(设NA为阿伏加德罗常数的值,用含NA、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷和甲醇可以做燃料电池,具有广阔的开发和应用前景,回答下列问题。
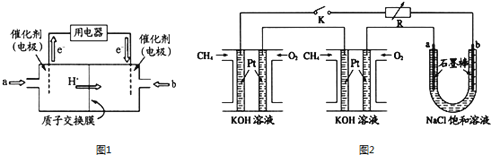
(1)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图1所示:通入b气体的电极是原电池的_________极(填“正”“负”),其电极反应式为_________________。
(2)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图2所示。闭合K后,若每个电池甲烷用量均为0.224L(标况),且反应完全,U形管中氯化钠溶液的体积为800mL(氯化钠足量),且在电解过程中溶液体积变化忽略不计,产生的气体全部逸出,则在石墨电极a产生的气体为____________(填化学式),该气体在标况下的体积为___________。在电解后将U型管中溶液混合均匀,其pH为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
B.煤可与水蒸气反应制成水煤气,水煤气的主要成分为CO和H2
C.石油裂化主要目的得到乙烯、丙烯和甲烷
D.以石油、煤和天然气为原料,可生产塑料、合成橡胶和合成纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 4 mol A 气体和 2 mol B 气体在 2 L 的定容容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g) △H<0 ,经 2 s(秒)后测得 C 的浓度为 0. 6 mol·L-1 ,现有下列几种说法:①用物质 A 表示的反应的平均速率为 0.3 mol·L-1s-1;②达到平衡状态时,升高温度,平衡逆向移动,化学平衡常数K减小;③2 s 时物质 A 的转化率为70% ;④达平衡时,增加A物质的量,平衡正向移动,A的转化率降低;⑤当B和C的生成速率相等时,该反应达到平衡状态。其中不正确的是( )
2C(g) △H<0 ,经 2 s(秒)后测得 C 的浓度为 0. 6 mol·L-1 ,现有下列几种说法:①用物质 A 表示的反应的平均速率为 0.3 mol·L-1s-1;②达到平衡状态时,升高温度,平衡逆向移动,化学平衡常数K减小;③2 s 时物质 A 的转化率为70% ;④达平衡时,增加A物质的量,平衡正向移动,A的转化率降低;⑤当B和C的生成速率相等时,该反应达到平衡状态。其中不正确的是( )
A.①③B.②⑤C.③⑤D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华优秀传统文化涉及到很多的化学知识。下列有关说法不正确的是![]()
![]()
A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
B.“火树银花合,星桥铁索开”,其中的“火树银花”涉及到焰色反应
C.![]() 天工开物
天工开物![]() 中记载:“以硝石、硫磺为主。草木灰为辅。
中记载:“以硝石、硫磺为主。草木灰为辅。![]() 魂散惊而魄齑粉”文中提到的是火药
魂散惊而魄齑粉”文中提到的是火药
D.![]() 天工开物
天工开物![]() 中有如下描述:“世间丝、麻、裘、褐皆具素质
中有如下描述:“世间丝、麻、裘、褐皆具素质![]() ”文中的“裘”主要成分是蛋白质
”文中的“裘”主要成分是蛋白质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com