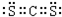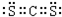(2009?西城区一模)X、Y、Z为周期表中前20号主族元素,原子序数递增,X、Y原子的最外层电子数是其电子层数的2倍,Z是人体含量最高的金属元素.
(1)下列含氧酸根化学式书写不正确的是
a
a
(填序号).
a.XO
3-b.XO
32-c.YO
32-d.Y
2O
32-
(2)X、Y的原子可构成只含极性键的非极性分子,它的电子式是
,空间构型是
直线型
直线型
.
(3)Y的最高价含氧酸是重要的化工产品.
①已知YO
2被空气氧化,每生成1mol气态YO
3,放出98.3kJ热量,该反应的热化学方程式是
SO2(g)+1/2O2(g)═SO3(g)△H=-98.3KJ/mol
SO2(g)+1/2O2(g)═SO3(g)△H=-98.3KJ/mol
.
②实验测得相同条件下一定量的Y单质分别在空气和在氧气中充分燃烧后产物的成分(体积分数)如表.
| |
YO2 |
YO3 |
| 空气 |
94%~95% |
5%~6% |
| 氧气 |
97%~98% |
2%~3% |
Y在纯氧中燃烧产物里YO
3含量比空气中少的原因是
纯氧中O2浓度大,单位时间内放热多,体系温度高,平衡向SO3分解的方向移动
纯氧中O2浓度大,单位时间内放热多,体系温度高,平衡向SO3分解的方向移动
.
③天然ZYO
4既可用于制备Y的氧化物又可用于制水泥.ZYO
4与X单质在高温下反应,得到两种常见气体.每消耗1molX单质,有4mol电子转移,该反应的化学方程式是
2CaSO4+C═2CaO+CO2↑+2SO2↑
2CaSO4+C═2CaO+CO2↑+2SO2↑
.
(4)为了测定某水泥样品成分,称取10.0g样品,将其中的Z元素转化为ZX
2O
4沉淀,将沉淀用稀酸处理得H
2X
2O
4溶液,取该溶液体积的1/100,用KMnO
4溶液滴定(氧化产物为XO
2,还原产物为Mn
2+),结果用去0.0200mol?L
-1的KMnO
4溶液24.00mL.该样品中Z的氧化物的质量分数是
67.2%
67.2%
.

 阅读快车系列答案
阅读快车系列答案