
| A. | 先滴加氯水,再滴加KSCN溶液后显红色 | |
| B. | 先滴加KSCN溶液,不显红色,再滴加氯水后显红色 | |
| C. | 滴加NaOH溶液,产生白色沉淀 | |
| D. | 只需滴加KSCN溶液 |
分析 Fe2+与KSCN不反应,具有还原性,可与氯水等发生反应生成Fe3+,与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁不稳定,被氧化生成氢氧化铁,以此解答该题.
解答 解:A.加入氯水,如含有Fe3+,则不能确定是否含有Fe2+,故A错误;
B.KSCN与Fe3+作用使溶液显红色,与Fe2+作用无此现象,先滴加KSCN溶液,不显红色,说明原溶液不含有Fe3+,再滴加氯水后显红色,说明滴加氯水后溶液中有Fe3+,证明原溶液含有Fe2+,故B正确;
C.与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁不稳定,被氧化生成氢氧化铁,现象是迅速变为灰绿色,最终生成红褐色沉淀,故C错误
D.只需滴加KSCN溶液,如含有铁离子,则不能检验,且只有铁离子发生颜色反应,故D错误.
故选B.
点评 本题考查了Fe2+、Fe3+的检验,侧重考查学生的分析能力和实验能力,注意把握亚铁离子的性质,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | lmo1CH4中含有的电子数为9NA | |
| B. | 0.1mol•L-1的Na2S溶液中所含阴离子的数目大于0.1NA | |
| C. | 1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为2NA | |
| D. | 80℃时,1LNaCl溶液中含有OH-的数目为1×10-7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤 | |
| B. | NaHCO3溶液(Na2CO3),通入过量的CO2气体 | |
| C. | 铝粉(Mg),加入足量的盐酸,过滤 | |
| D. | FeCl2溶液(FeCl3),通入足量的氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80% | B. | 83% | C. | 75% | D. | 91% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | |||
| Y | Z | V |
| A. | W有多种同素异形体,且均具有高熔点、高沸点的性质 | |
| B. | Z的第一电离能小于V的第一电离能 | |
| C. | Y、Z与X的常见稳定液态氧化物反应的剧烈程度Y大于Z | |
| D. | X的离子半径一定小于与Y同族的短周期元素的离子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN | B. | BaCl2 | C. | HCl | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡后加入N2,当重新达到平衡时,NH3的浓度比原平衡的大,N2的浓度比原平衡的小 | |
| B. | 达到平衡后,升高温度,既加快了正、逆反应速率,又提高NH3的产率 | |
| C. | 达到平衡后,缩小容器体积,既有利于加快正、逆反应速率,又有利用提高氢气的转化率 | |
| D. | 加入催化剂可以缩短达到平衡的时间,是因为正反应速率增大了,而逆反应速率减小了 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
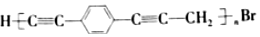 .下列说法正确的是( )
.下列说法正确的是( )| A. | 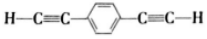 和苯乙炔互为同系物 和苯乙炔互为同系物 | |
| B. | 炔烃和卤代烃在一定条件下可发生取代反应 | |
| C. | 高分子材料P不指使溴的四氯化碳溶液褪色 | |
| D. | 生成P的单体是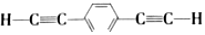 和CH3Br 和CH3Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com