
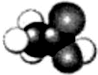
 乙酸是食醋的主要成分,它的分子结构模型如图所示.
乙酸是食醋的主要成分,它的分子结构模型如图所示.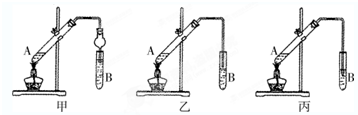
分析 (1)-COOH原子团的名称为羧基;
(2)乙酸显酸性,能使石蕊试液变红色;
(3)①吸收极易溶于水的气体时,若将导管伸入水中,由于气体溶于水,导致装置内压强急剧降低,外界大气压压着液体进入,产生倒吸现象;
②乙酸能与乙酸发生反应生成乙酸乙酯,为酯化反应,也属于取代反应.
解答 解:(1)乙酸是饱和一元羧酸,其-COOH原子团的名称为羧基;
故答案为:羧基;
(2)乙酸是一种有机酸,在溶液转化部分电离出氢离子,显酸性,能使石蕊试液变红色;
故答案为:红;
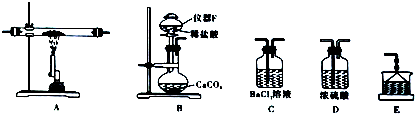
(3)①甲、乙、丙三套装置中,甲装置中,导管伸入吸收液中,并且连接了体积较大的容器,既能够防止倒吸,又能够很好的吸收乙酸乙酯中的乙酸和乙醇,乙装置中,将导管伸入液面上,能够很好的吸收乙酸乙酯中的乙酸和乙醇,可防止倒吸,丙装置中将导管伸入饱和碳酸钠溶液中,由于乙酸和乙醇溶于饱和碳酸钠溶液,导致装置内压强急剧降低,外界大气压压着液体进入,产生倒吸现象;
故答案为:丙;
②乙酸能与乙酸发生反应生成乙酸乙酯,该反应为CH3COOH+CH3CH2OH$?_{△}^{H_{2}SO_{4}}$CH3COOCH2CH3+H2O,为酯化反应,也属于取代反应,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{H_{2}SO_{4}}$CH3COOCH2CH3+H2O;酯化(或取代).
点评 本题考查了乙酸乙酯的制备,题目难度不大,注意掌握乙酸与乙醇的反应原理及乙酸的化学性质,试题侧重基础知识的考查,有利于提高学生灵活应用基础知识的能力.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
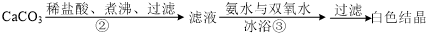
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
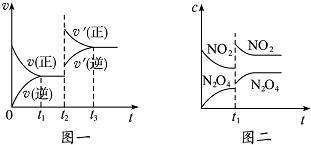
| A. | 图一t2时改变的条件可能是升高了温度或增大了压强 | |
| B. | 图一t2时改变的条件是增大压强,则反应的△H增大 | |
| C. | 图二t1时改变的条件可能是升高了温度 | |
| D. | 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的离子积常数KW | B. | 可逆反应的平衡常数K | ||
| C. | 0.1mol/LCH3COONa溶液的pH | D. | NH3•H2O的电离常数Kb |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
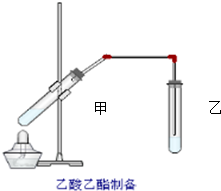 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
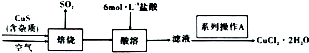
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
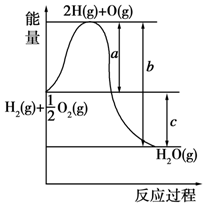 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,请回答下列问题.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8mol/L | B. | 1.6mol/L | C. | 0.9mol/L | D. | 1.8mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com