
分析 (1)因锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨;
(2)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡;
(3)指示剂为甲基橙,变色范围为3.1-4.4;
(4)因标准液浓度变小,用量变大;
(5)根据反应消耗的盐酸,求出氢氧化钠,进一步求出样品的纯度.
解答 解:(1)因锥形瓶下垫一张白纸使滴定终点颜色变化更明显,便于分辨,
故答案为:便于准确判断滴定终点时溶液的颜色变化情况;
(2)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡,
故答案为:充满溶液无气泡;
(3)指示剂为甲基橙,变色范围为3.1-4.4,溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色,
故答案为:指示剂颜色由黄色变为橙色;
(4)因标准液浓度变小,用量变大,故答案为:偏高;
(5)滴到消耗的硫酸为:n(盐酸)=CV=C(V1-V)×10-3,根据反应方程可知,n(NaOH)=(盐酸)=C(V1-V)×10-3mol,所以原来样品中氢氧化钠的物质的量为:C(V1-V)×10-3×$\frac{250}{25}$=C(V1-V)×10-2mol,则样品中氢氧化钠的质量为C(V1-V)×10-2×40g,则该烧碱样品的纯度为:$\frac{C({V}_{1-}V)×1{0}^{-2}×40}{W}×100%$=$\frac{40C({V}_{1}-V)}{W}%$.
故答案为:$\frac{40C({V}_{1}-V)}{W}%$.
点评 本题综合考查酸碱中和滴定,侧重于化学实验基本操作以及物质的含量的测定等问题,题目难度中等.


科目:高中化学 来源: 题型:解答题
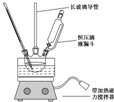 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: +HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+
+HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+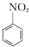 +H2O
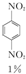
+H2O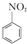 +HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$
+HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$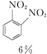 +
+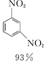 +
+
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
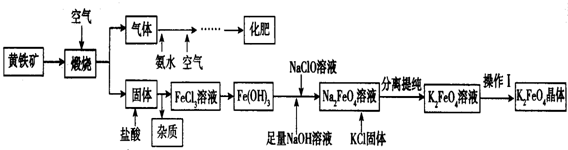
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

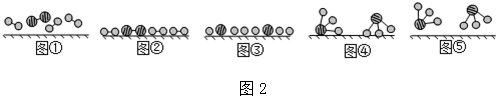
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
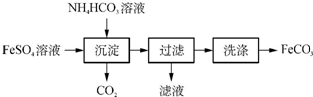
| 实验步骤 | 实验操作步骤 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ | 取少量实验步骤Ⅰ所得固体置于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锥形瓶用蒸馏水洗涤后,直接盛盐酸溶液 | |
| B. | 中和滴定将要达到滴定终点时,眼睛注视滴定管中液面的位置变化 | |
| C. | 滴定管装碱液前未用标准碱液润洗 | |
| D. | 滴定时,锥形瓶摇动太剧烈,有少量溶液溅出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①②③ | D. | ③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com