
【题目】下列描述的化学反应状态,不一定是平衡状态的是( )
A.3H2(g)+N2(g)![]() 2NH3(g)反应体系中H2与N2的物质的量之比保持3∶1
2NH3(g)反应体系中H2与N2的物质的量之比保持3∶1
B.2NO2(g) ![]() N2O4(g)恒温、恒容下,反应体系中气体的压强保持不变
N2O4(g)恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s) ![]() O2(g)+CaO(s)恒温、恒容下,反应体系中气体的密度保持不变
O2(g)+CaO(s)恒温、恒容下,反应体系中气体的密度保持不变
D.H2(g)+Br2(g) ![]() 2HBr(g)恒温、恒容下,反应体系中气体的颜色保持不变
2HBr(g)恒温、恒容下,反应体系中气体的颜色保持不变
【答案】A
【解析】
判定化学反应达到平衡,一般有两种方法,一种是v正=v逆,另一种是变量不变。
A.如果刚开始加入H2和N2的物质的量之比为3:1,或开始加入的是NH3,反应的任何时刻H2和N2的物质的量之比始终是3:1,因此H2和N2的物质的量之比为3:1时,不一定达到平衡,A符合题意;
B.由于该反应反应前后的气体系数之和不等,当压强保持不变时,各物质的物质的量也不再变化,因此该反应已经达到平衡,B不符合题意;
C.该反应反应过程中,由于CaCO3和CaO都是固体,气体的质量一直在发生变化,因为容器的体积不变,根据![]() ,密度在反应过程中发生变化,当密度保持不变时,说明已达到平衡,C不符合题意;
,密度在反应过程中发生变化,当密度保持不变时,说明已达到平衡,C不符合题意;
D.该体系中有颜色的气体为溴蒸汽,当颜色不变时,说明溴蒸汽的浓度也不在变化,因此该反应已经达到平衡,D不符合题意;
故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】二氟磷酸锂(LiPO2F2)作为电解液添加剂能够有效提升锂电池的循环性能。在氮气气氛下,在PFA(全氟烷氧基树脂)烧瓶中加入高纯LiPF6和Li2CO3固体,以碳酸二甲酯作溶剂制备LiPO2F2,其流程如下:
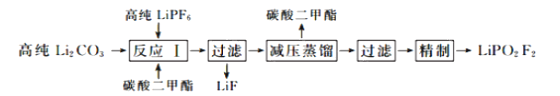
已知:LiPF6是一种白色结晶或粉末,潮解性强,遇水发生反应如下:LiPF6+H2O![]() LiF+POF3↑+2HF↑
LiF+POF3↑+2HF↑
(1)反应Ⅰ需要控制在60℃的条件下进行,适宜的加热方式为_____________。
(2)反应Ⅰ中有一种无色无味的气体生成,该气体的电子式为_______________。反应Ⅰ的化学方程式为______________________________________。
(3)高纯LiPF6需要控制适当过量的原因可能是_____________________________。 LiPO2F2制备过程中不采用玻璃仪器的原因是____________________________。
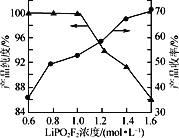
(4)保持其他实验条件都不变,在精制过程中加入提纯溶剂(杂质和LiPO2F2均可溶解在提纯溶剂中),LiPO2F2在提纯溶剂中的浓度对产品纯度和收率(收率=![]() ×100%)的影响如图所示。由图可知,随着LiPO2F2浓度的减小,产品纯度逐渐增大,收率逐渐降低。其原因可能是_______
×100%)的影响如图所示。由图可知,随着LiPO2F2浓度的减小,产品纯度逐渐增大,收率逐渐降低。其原因可能是_______
(5)已知:常温下,碳酸锂微溶于水,碳酸氢锂可溶于水。工业级碳酸锂中含有少量难溶于水且与CO2不反应的杂质。请设计从工业级碳酸锂制备高纯碳酸锂的实验方案。(实验中须使用的试剂有:去离子水,CO2气体;除常用仪器外须使用的仪器:恒温水浴锅、真空干燥箱)__________
(6)已知碳酸锂Ksp=8.6×10-4,向浓度为0.2mol·L-1的硫酸锂溶液中加入等体积的碳酸钠溶液产生沉淀,则所加碳酸钠溶液的最低浓度为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是
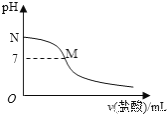
A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
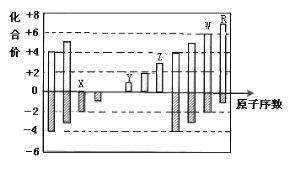
A.原子半径:Z>Y>X
B.气态氢化物的热稳定性:W>R
C.WX3和水反应生成的化合物是离子化合物
D.X元素在自然界中存在同素异形现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂质的操作方法正确的是( )
A.N2 中有少量的 CO:通过灼热的氧化铜
B.食盐中有少量的 NH4Cl:加过量的烧碱溶液后加热蒸干
C.NO 中有少量的 NO2:用水洗涤后再干燥
D.NO2 中有少量 NH3:用水洗涤后干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与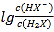 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2(SO4)3溶液可除去煤中以黄铁矿(FeS2)形式存在的硫元素,反应如下:
______FeS2 + ______Fe2(SO4)3 +______H2O →______FeSO4 + ______H2SO4
(1)试配平反应的化学方程式,并用单线桥标出电子转移方向及数目_____;还原剂是_______,还原产物是_________,被还原的元素是__________。
(2)Fe2(SO4)3溶液呈_____性,用离子方程式解释其原因________。
(3)检验上述反应中Fe2(SO4)3是否消耗完的实验方案:_________________________。
(4)该方法的优点之一是Fe2(SO4)3易再生。向反应后的溶液中通入__________,就能达到使Fe2(SO4)3再生的目的,方便且价廉。
(5)实验室.配制一定量FeSO4溶液时,需加入少量_____和_______其目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
B.向氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C.醋酸洗涤铜器表面的碱式碳酸铜:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
D.向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2009年我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。
(1)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是___。
a.比较这两种元素的单质的硬度和熔点
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.将空气中放置已久的这两种元素的单质分别和热水作用
(2)BeCl2熔点较低,易升华,其化学性质与AlCl3相似,可推测BeCl2熔融态___(选填“导电”或“不导电”),请写出BeCl2水解的化学方程式___。
(3)铝及其化合物在日常生活、工业上有广泛的应用。国产C919飞机外壳应用了铝合金材料。下列铝合金的性质与其用于飞机外壳无关的是(_______)
a.密度小 b.能导电 c.抗腐蚀性能强 d.硬度大
(4)Al2O3、MgO和SiO2都可以制耐火材料,其原因是___。
a.Al2O3、MgO和SiO2都不溶于水 b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物 d.Al2O3、MgO和SiO2都有很高的熔点
(5)明矾可作净水剂。明矾(KAl(SO4)2·12H2O)的水溶液呈___性(选填“酸”、“碱”或“中”),写出明矾在水溶液中的电离反应方程式___;溶液中离子浓度大小顺序为___。
(6)氢氧化铝是用量最大、应用最广的无机阻燃添加剂,解释氢氧化铝能做阻燃剂的原因___(用方程式说明);写出Al(OH)3的电离方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com