
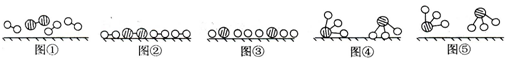
分析 (1)图②是表示N2、H2被吸附在催化剂的表面;图③则表示在催化剂表面,N2、H2中的化学键断裂;
(2)利用盖斯定律,把第二个热化学方程式两边扩大2倍,然后两个方程式相加就可以得到氨催化氧化的热化学方程式;
(3)①依据平衡常数概念计算,用平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;依据计算的浓度商和平衡常数比较分析判断反应进行的方向;
②依据化学平衡三段式列式计算A的体积分数相等列式计算.
解答 解:(1)分析题中图可以知道,图②表示N2、H2被吸附在催化剂表面,而图③表示在催化剂表面,N2、H2中化学键断裂,
故答案为:N2、H2被吸附在催化剂表面;在催化剂表面,N2、H2中化学键断裂;
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1 266.8kJ/mol ①
N2(g)+O2(g)=2NO(g)△H=+1 80.5kJ/mol ②
①+②×2得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol;
(3)①若在某件下,反应N2(g)+3H2(g)?2NH3(g)在容器B中达到平衡,测得容器中含有1.0mol N2,0.4mol H2,0.4mol NH3,此时容积为2.0L.则此条件下的平衡常数K=$\frac{(\frac{0.4mol}{2L})^{2}}{\frac{1mol}{2L}×(\frac{0.4mol}{2L})^{3}}$=10;
保持温度和压强不变,向此容器内通入0.36mol N2,此时容器体积为2.4L,所以Q(c)=$\frac{(\frac{0.4}{2.4})^{2}}{\frac{1.36}{2.4}×(\frac{0.4}{2.4})^{3}}$=10.6>10,反应逆向进行;
故答案为:10; 逆向;
②向A、B两容器中均通入x mol N2和y mol H2,初始A、B容积相同,并保持温度不变.设A容器中消耗N2物质的量amol,B容器中消耗N2物质的量为bmol,
A容器中 N2(g)+3H2(g)?2NH3(g),
起始量(mol) x y 0
变化量(mol) a 3a 2a
平衡量(mol) x-a y-3a 2a
B容器中 N2(g)+3H2(g)?2NH3(g),
起始量(mol) x y 0
变化量(mol) b 3b 2b
平衡量(mol) x-b y-3b 2b
若要平衡时保持N2气体在A、B两容器中的体积分数相等,$\frac{x-a}{x+y-2a}$=$\frac{x-b}{x+y-2b}$,x:y=(b-a):(b-a),则x:y=1:1,
则起始通入容器中的N2的物质的量x mol与B的物质的量y mol之间必须满足的关系式为x=y=1,
故答案为:x=y.
点评 本题主要考查了反应原理、热化学方程式的书写、平衡移动的判断、等效平衡的应用等知识点,中等难度,注意等效平衡原理的应用.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 液态氧、烧碱、碘酒 | B. | 白磷、生石灰、熟石灰 | ||
| C. | 铁、干冰、氯化氢 | D. | 氮气、空气、胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.
图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学在材料科学、生命科学、能源科学等诸多领域发挥着重要的作用.
化学在材料科学、生命科学、能源科学等诸多领域发挥着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
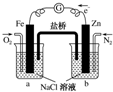
| A. | 烧杯a中的溶液pH降低 | B. | 烧杯b中发生的反应为2H++2e-═H2↑ | ||
| C. | 烧杯a中发生的反应为Fe-2e-═Fe2+ | D. | 烧杯b中发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应类型 | 反应条件 |
| A | 加成反应、取代反应、消去反应 | NaOH醇溶液/加热、NaOH水溶液/加热、常温 |
| B | 消去反应、加成反应、水解反应 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
| C | 消去反应、加成反应、取代反应 | NaOH醇溶液/加热、常温、NaOH水溶液/加热 |
| D | 氧化反应、取代反应、消去反应 | 加热、NaOH醇溶液/加热、NaOH水溶液/加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 接触法制备硫酸主要的设备有沸腾炉、合成塔和吸收塔 | |
| B. | 工业制备硫酸中,尾气二氧化硫使用NaOH溶液吸收的 | |
| C. | 工业制备硫酸中,三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使三氧化硫吸收完全 | |
| D. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
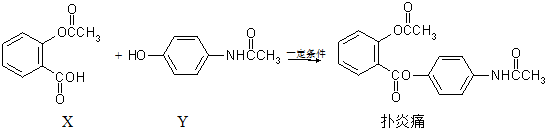
| A. | 扑炎痛的分子式为C17H16NO5 | |
| B. | 可用FeCl3溶液检验扑炎痛中是否含有化合物Y | |
| C. | 扑炎痛在酸性条件下水解最终可以得到3种物质 | |
| D. | 1 mol扑炎痛与足量的NaOH溶液反应,最多消耗3 mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com