
下表中的实验操作能达到实验目的或能得出相应结论的是( )
选项 | 实验操作 | 实验目的或结论 |
A | 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤。 | 除去Mg(OH)2样品中的Ca(OH)2 |
B | 取少量KClO3晶体溶于适量的蒸馏水,再加入硝酸 酸化的AgNO3溶液。 | 检验KC1O3中的氯元素 |
C | 向某溶液中滴加Ba(NO3)2溶液产生白色沉淀,再加稀盐酸沉淀消失。 | 说明原溶液中一定含有CO32-或SO32- |
D | 向盛有1mL 0.01lmol·L-1AgNO3溶液的试管中滴加5滴0.0lmol·L-1NaCl溶液,有白色沉淀生成,再向其中滴加0.01 mol·L-1 NaI溶液,产生黄色沉淀。 | 常温下, Ksp(AgCl)>Ksp(AgI)
|
A
【解析】
试题分析:A. Ca(OH)2微溶于水,而Mg(OH)2难溶于水,当向该混合物中加入足量饱和氯化镁溶液时,会发生沉淀反应,产生难溶的Mg(OH)2沉淀,使Ca(OH)2的沉淀溶解平衡被破坏,继续溶解,最后完全转化为Mg(OH)2沉淀,从而达到除去Mg(OH)2样品中的Ca(OH)2杂质的目的。正确。B.在KClO3中Cl元素是以ClO3-的形式存在,所以溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液,不会产生AgCl白色沉淀。错误。C.向某溶液中滴加Ba(NO3)2溶液产生白色沉淀,再加稀盐酸沉淀消失的则原溶液可能含有CO32-,也可能含有PO43-。向含有SO32-的溶液中加入Ba(NO3)2溶液会产生BaSO3白色沉淀,再加入硝酸时,由于硝酸有强氧化性,会把BaSO3氧化为既不溶于水,也不溶于酸的BaSO4,因此错误。D. 向盛有1mL 0.01lmol·L-1AgNO3溶液的试管中滴加5滴0.0lmol·L-1NaCl溶液,由于c(Cl-)·c(Ag+)> Ksp(AgCl),所以会形成白色AgCl沉淀。该物质难溶,也有一定的溶解度,在溶液中存在沉淀溶解平衡,再向其中滴加0.01 mol·L-1 NaI溶液,因为产生黄色沉淀。c(I-)·c(Ag+)> Ksp(AgI),所以会形成黄色AgI沉淀,破坏了AgCl沉淀溶解平衡,AgCl继续溶解,又形成AgI沉淀。最终沉淀有白色变为黄色。这与二者的溶度积常数的大小无关。错误。
考点:考查实验操作与实验目的相应结论的关系的知识。


科目:高中化学 来源:2013-2014山东省临沂市高三5月二模理综化学试卷(解析版) 题型:填空题
(18分)NOx、SO2是主要的大气污染物,科学处理这些污染物对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H= kJ?mol-1。
(2)利用氧化氮氧化物的流程如下:
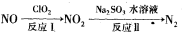
写出反应Ⅱ的化学方程式 ___________________;已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移0.5mol电子,则反应Ⅱ中可生成N2的体积
为_________L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_________移动(填“向左”、“向右”或“不”);试计算溶液中  。
。
(常温下H2SO3的电离常数: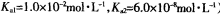 )
)
(4)利用Fe2(SO4)3溶液也可处理SO2废气,其流程如下图所示。
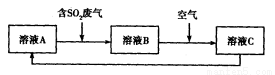
①简述用Fe2(SO4)3晶体配制溶液A的方法__________________。
②假设反应过程中溶液的体积不变,A、C两溶液的pH大小关系为:pH ___pH
___pH 。(填
。(填
“>”、“=”或“<”)。
③设计实验验证溶液B是否仍具有处理废气的能力,简述实验的操作、现象和结论_____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省蚌埠市高三第二次教学质量检测理科综合化学试卷(解析版) 题型:实验题
(12分)氯酸钾热分解是实验室制取氧气的一种方法,某探究小组查阅资料得知,氯酸钾在不同条件下分解结果如下:
实验 | 反应体系 | 第一放热峰温度(℃) | 第二放热峰温度(℃) |
l | KC1O3 | 400(无气体放出) | 480(有少量气体放出) |
2 | KC1O3+MnO2 | 350(有大量气体放出) |
|
已知实验1在480℃时反应方程式为KClO4 KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。
KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。
该小组同学利用实验2来制取氧气时,在实验中发现生成的气体略带颜色、并有刺激性气味。
【提出问题】实验中生成的气体中除了氧气外还含有什么物质?
【查阅资料】1.二氧化氯常温下是黄色有强烈刺激性气味的气体
2.二氧化氯具有强氧化性,在溶液中能够把二价锰氧化成四价锰,使之形成不溶于水的二氧化锰(2ClO2+5Mn2++6H2O=5MnO2↓+12H++2Cl—),而氯气不能。
【提出假设】假设l:含有氯气;假设2:含有二氧化氯。
【设计实验】甲同学设计实验验证假设1成立。
实验步骤 | 实验现象 | 实验结论 |
将产生的气体接触湿润的淀粉碘化钾试纸 |
| 假设l正确 |
乙同学设计实验验证假设2成立。
实验步骤 | 实验现象 | 实验结论 |
|
| 假设2正确 |
【思考与交流】你同意他们的实验方案吗,理由是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省蚌埠市高三第三次教学质量检查理综化学试卷(解析版) 题型:选择题
化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,下列关于描述正确的是
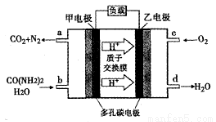
A、电池工作时H+ 移向负极
B、该电池用的电解质溶液是KOH溶液
C、甲电极反应式为:CO(NH2 )2 + H2O - 6e-= CO2 + N 2 + 6H+
D、电池工作时,理论每有净化1mol CO(NH2 )2 ,消耗 33.6 L O2
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省皖南八校高三第三次联考理综化学试卷(解析版) 题型:推断题
(14分)F是治疗慢性髓样白血病的新药伊马替尼的中间体,可由下列路线合成:
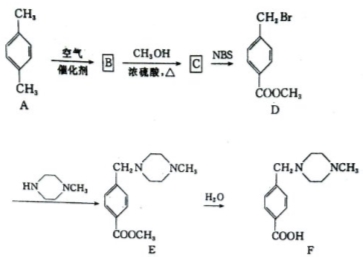
(1)写出下列反应的反应类型
A→B D→E
(2)满足下列条件的C的同分异构体有 种,写出其中一种的结构简式
①是二取代苯 ②含有醛基 ③能与FeCl3溶液发生显色反应
(3) NBS(N-溴代丁二酰亚胺通常情况下是一种白色固体),是有机合成中一种很有用的溴代剂,其结构简式为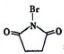 ,则反应C→D的化学方程式为 ,
,则反应C→D的化学方程式为 ,
下列有关说法中错误的是____(填字母)。
A.该反应是加成反应 B.NBS的分子式为C4H4BrNO2
C.加入适当的溶剂可以加快反应的反应速率
D.C与液溴反应也能转化为D,但可能会造成污染
(4)D在强碱溶液中充分水解后再酸化,所得有机产物发生反应生成高聚物的化学方程式为:
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省淮南市下学期期末考试高一化学试卷(解析版) 题型:填空题
下表列出了①~⑩十种元素在周期表中的位置:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 |
|
|
| ① | ② |
|
|
|
3 | ③ | ④ | ⑤ | ⑥ |
| ⑦ | ⑧ | ⑩ |
4 |
|
|
|
|
|
| ⑨ |
|
⑴上述①~⑩十种元素中(用元素符号填空):
构成有机物的主要元素是 ,构成岩石与许多矿物的基本元素是 ,
化学性质最不活泼的元素 ,气态氢化物的水溶液呈碱性的元素 。
⑵上述①~⑨元素的最高价氧化物对应的水化物中:
碱性最强的物质的电子式为 ,酸性最强的物质的化学式为 。
⑶若以元素④和⑤的单质为电极,与元素③的最高价氧化物对应的水化物的水溶液组成原电池,则④的单质在此原电池中作______极(填“正”或“负”)
⑷元素⑦的某氧化物为有刺激性气味的无色气体,其氢化物为有臭鸡蛋气味的无色气体。若这两种气体混合,会生成一种淡黄色粉末。此反应化学方程式为 。若此反应中氧化产物的质量为3.2g,则反应中转移的电子数为 (填数值)。
⑸元素⑧和元素⑨两者核电荷数之差是 ,这两种元素中非金属性较弱的元素是 (填元素名称),能说明这两种元素的非金属性强弱的实验事实是(用离子方程式表示)
。
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省淮南市下学期期末考试高一化学试卷(解析版) 题型:选择题
下列实验中,不能观察到明显变化的是( )
A.把一小段打磨过的铝片放入少量冷水中 B.把氯气通入FeCl2溶液中
C.把绿豆大的钾投入盛在大烧杯内的水中 D.把溴水滴加到KI淀粉溶液中
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省高二(下)期末考试化学试卷(解析版) 题型:填空题
(14分)Q、W、X、Y、Z均为元素周期表中前四周期元素,且其原子序数依次增大,Q元素的阳离子核外无电子,W元素原子的最外层电子数是其次外层电子数的2倍,Y是地壳中含量最多的元素,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
⑴W位于元素周期表第 周期第 族。Y的第一电离能 (填“大于”或“小于”)X的第一电离能。
⑵XQ3分子中的化学键类型为 (填“极性”或“非极性”)共价键,空间类型为 。Q—X﹑Q—Y﹑Q—W中键长最短的是 。
⑶Z的基态原子核外电子排布式是 ,Z的单质与X的最高价氧化物对应水化物的稀溶液反应的离子方程式为 。
⑷已知:①WQ4(g) +4XY2(g) ﹦4XY(g)+WY2 (g)+2Q2Y(g) △H﹦-574KJ·mol-1
②WQ4(g) +4XY(g) ﹦2X2 (g) +WY2 (g) +2Q2Y(g) △H﹦-1160KJ·mol-1
则由WQ4还原XY2生成X2的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:填空题
(8分)某氮肥厂氨氮废水中氮元素多以 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下:

(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用: 。
(2)过程Ⅱ:在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。其中第一步反应的能量变化示意图如下:
。其中第一步反应的能量变化示意图如下:

第一步反应是 反应(选填“放热”或“吸热”),判断依据是
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com