
实验室需要0.1 mol/L NaOH溶液450 mL和0.5mol/L硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是 (填字号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
(2)下列操作中,是容量瓶所具备的功能有 。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.配制任意浓度和体积的标准溶液 D.稀释某一浓度的溶液 E.量取一定体积的液体
(3)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度 (填“大于”“等于”或“小于”)0.1 mol/L。若NaOH溶液在转移至容量瓶时,洒落了少许,则需要如何操作: 。
(4)根据计算得知,所需质量分数为98%、密度为l.84 g/cm3的浓硫酸的体积为 ml。如果实验室有10 mL,15 mL,20 mL量筒,应选用 mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
(5)下列操作会使配制的NaOH溶液浓度偏低 的是。
A.用滤纸称量NaOH B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线 D.整个配制过程中,容量瓶不振荡
(1)BDE(2分);烧杯和玻璃棒(2分);(2)AE(1分);(3)2.0(1分);大于(1分);重新配置(1分);(4)13.6(1分);15(1分);将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌2分) (5)AC(2分)
解析试题分析:(1)用容量瓶配制溶液,用胶头滴管定容,用量筒量取浓硫酸;还需要用到的仪器有:溶解或稀释药品的烧杯、搅拌或引流用的玻璃棒,故答案为:BDE;烧杯和玻璃棒;
(2)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,故选AE;
(3)m=cVM=0.1mol/L×0.5L×40g/mol=2.0g,若定容时俯视刻度线,溶液的体积偏小,则所得溶液浓度大于0.1mol?L-1,若NaOH溶液在转移至容量瓶时,洒落了少许,溶质的物质的量偏小,则只能是重新配置;
(4)浓硫酸的浓度c=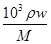 =(103×1.84×98%)÷98mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.5/L×0.5L,V=0.0136L=13.6mL,选取的量筒规格应该等于或大于量取溶液体积,故选15mL量筒,稀释浓硫酸的正确操作是:将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌,防止液体溅出;
=(103×1.84×98%)÷98mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.5/L×0.5L,V=0.0136L=13.6mL,选取的量筒规格应该等于或大于量取溶液体积,故选15mL量筒,稀释浓硫酸的正确操作是:将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌,防止液体溅出;
(5)A、用滤纸称量NaOH,则由于氢氧化钠易吸水和二氧化碳,则实际称量的质量偏少,测定结果偏低,A正确;B、选用的容量瓶内有少量蒸馏水,对溶质的物质的量及溶液的体积都没有影响,所以不影响配制结果,故B错误;C、定容摇匀后,液面下降,又加水至刻度线,则测定结果偏低,C正确;
D、先加入的是密度较大的NaOH溶液,后加入的洗涤烧杯和玻璃棒的溶液密度较小,造成溶液密度不均匀,如果摇均匀密度大的和密度小的相溶体积会比二者原体积之和小,所配制溶液浓度偏大,故D错误;故答案为:AC。
考点:考查配制一定物质的量浓度的溶液的方法


科目:高中化学 来源: 题型:单选题
设nA为阿伏加德罗常数的值,下列说法正确的是(相对原子质量:C-l2 H-1)
| A.2.24L NO2含有0.2nA个氧原子 |
| B.常温常压下,C2H4和C3H6组成的28g混合气体中含4nA个氢原子 |
| C.1 molC2H6分子中含有7nA个极性键 |
| D.常温下pH=13的NaOH溶液中含有的0.1 nA个OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知25%的氨水的密度为0.91 g/ml,5%的氨水密度为0.98 g/ml,若将上述两种氨水等体积混合,所得氨水的质量分数 ( )
| A.等于15% | B.大于15% | C.小于15% | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在MgCl2、Cl2、Ca(ClO)2、HClO2、( )、Cl2O7的排列中,括号内应填入的物质的化学式是
| A.Cl2O3 | B.KClO4 | C.KClO3 | D.HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铁、铝各1mol组成的混合物溶于一定量的盐酸,恰好完全反应后,再加入3mol Na2O2固体使之充分反应,最终产物是( )
| A.Fe(OH)2、Al(OH)3、NaCl |
| B.Fe(OH)2、Al(OH)3、NaAlO2、NaCl |
| C.Fe(OH)3、NaAlO2、NaCl |
| D.Fe(OH)3、Al(OH)3、NaAlO2、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(7分)
(1)利用Zn+2FeCl3=ZnCl2+2FeCl2反应,设计一个原电池,写出电极反应式。 正极 ,负极 ,电解质溶液 ,电极反应式 、 。
(2)下列操作中能使所配制的NaOH溶液浓度偏高的是
A 称量的是长期暴露在空气中的NaOH
B 容量瓶不干燥
C 将溶解于烧杯中的NaOH溶液未经冷却就转移到容量瓶中进行配制。
D 混匀容量瓶中溶液后,发现液面低于刻度线,再向容量瓶中加蒸馏水至刻度线
E.定容时,俯视液面使之与刻度线相切
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2体积(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)。试计算:(无需书写计算步骤)
(1)盐酸的物质的量浓度为 mol/L。
(2)该样品中NaOH与Na2CO3物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D。加热D发现无任何物质存在,把D溶于水测得溶液的pH小于7。已知气体C在标准状况下的密度为0.76g·L-1。
(1)A的化学式为 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
(3)1molSCl2能与2mol乙烯发生加成反应生成一种化学毒气芥子气,写出发生反应的化学方程式 。
(4)亚硝酸钠和D固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。
(5)请设计检验物质D的实验方案 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下: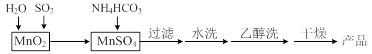
已知:MnCO3难溶于水和乙醇,受热易分解。
⑴ 实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、 。
⑵①检验水洗是否合格的方法是 。
②水洗结束后,用乙醇洗涤的目的是 。
⑶ MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com