
 H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑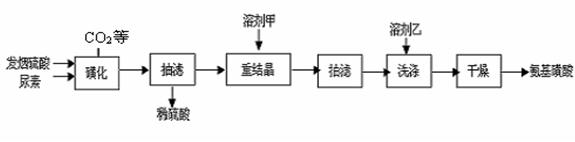

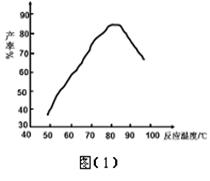
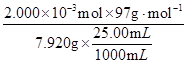 ×100% = 98.0% 。
×100% = 98.0% 。

科目:高中化学 来源:不详 题型:单选题
| A.高温多雨时比较适合施用钾肥 |
| B.长期施用硫铵会造成土壤板结 |
| C.石硫合剂必须与硫酸混合后才能施用 |
| D.草木灰可以和铵态氮肥一块施用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.燃烧硫生成SO3 | B.SO3与水反应生成H2SO4 |
| C.SO2氧化成SO3需要使用催化剂 | D.主要设备是沸腾炉、接触室、吸收塔 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
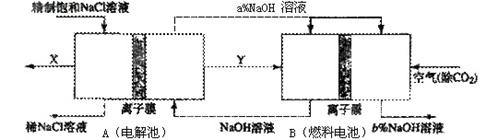 ①分析比较图中氢氧化鈉质量分数大小:a% (填“>”、“<”或“=”) b%, 理由是
①分析比较图中氢氧化鈉质量分数大小:a% (填“>”、“<”或“=”) b%, 理由是查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
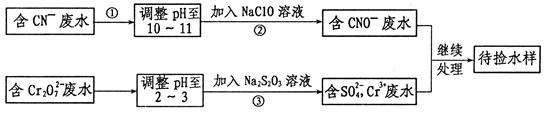
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③ | B.①③ | C.①②③ | D.②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
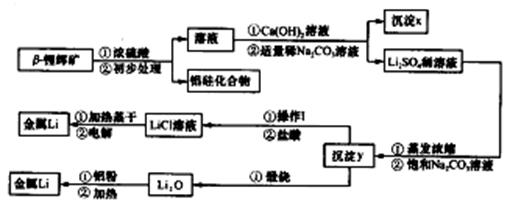
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 。 400℃、30MPa下n(NH3)和n(H2)
。 400℃、30MPa下n(NH3)和n(H2)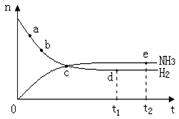
| A.点a的正反应速率比b点的大 |
| B.点c处反应还未达到平衡 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D.其他条件不变,500℃下反应至t1时刻, n(H2)比图中d点的值大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
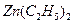 .
.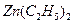 可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌的方法______。
可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌的方法______。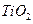 ) 替代明矾,钛白粉的一种工业制法是以钛铁矿(主要成分
) 替代明矾,钛白粉的一种工业制法是以钛铁矿(主要成分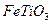 ),为原料按下过程进行的,请
),为原料按下过程进行的,请 完成下列化学方程式
完成下列化学方程式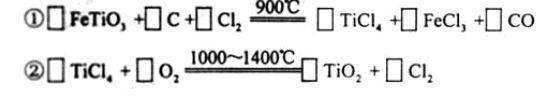
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com