
 ,
, ;
;

 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
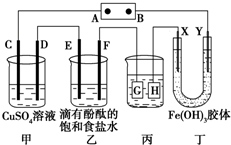 如图所示装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中的溶液都是1mol?L-1 500mL(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:
如图所示装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中的溶液都是1mol?L-1 500mL(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| (I) | (Ⅱ) | |
| A | 少量SO2通人Ba(OH)2溶液 | 过量SO2通入少量Ba(OH)2溶液 |
| B | 少量浓氨水滴入Al2(SO4)3溶液 | 少量Al2(SO4)3溶液滴入浓氨水 |
| C | 0.1molCl2通人含0.2molFeBr2的溶液 | 0.3molCl2通入0.2mol FeBr2溶液中 |
| D | 过量BaCl2溶液与少量Na2SO3溶液相混合 | 少量Ba(NO3)2溶液与过量MgSO4溶液相混合 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体的分散质能透过滤纸 |
| B、胶体能产生丁达尔现象 |
| C、胶体的分散质粒子直径在1~100nm之间 |
| D、胶体是纯净物,其它分散系是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
| 第三次 | 20.00 | 3.50 | 26.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com