
 CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应);
CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应); ;D的一种同分异构体的结构简式为CH3CHO.
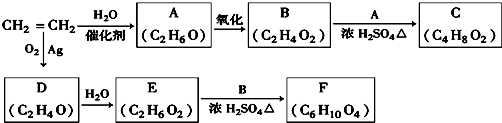
;D的一种同分异构体的结构简式为CH3CHO.分析 乙烯与水加成生成A为乙醇,乙醇催化氧化生成B为乙酸,乙酸与乙醇反应生成C为乙酸乙酯,乙烯与氧气反应生成D(C2H4O),D为环氧乙烷 ,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯
,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯 ,据此解答.
,据此解答.
解答 解:乙烯与水加成生成A为乙醇,乙醇催化氧化生成B为乙酸,乙酸与乙醇反应生成C为乙酸乙酯,乙烯与氧气反应生成D(C2H4O),D为环氧乙烷 ,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯
,因为后面生成物要与乙酸发生酯化反应按1:2反应,D→E是开环加成反应,故E为乙二醇,乙二醇与乙酸反应生成F(C6H10O4),F为二乙酸乙二酯 .
.
(1)由上述分析可知,A是乙醇,其核磁共振氢谱有 3个峰,故答案为:乙醇;3;
(2)B和A反应生成C是乙酸与乙醇反应生成乙酸乙酯,反应方程式为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应),
CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应),
故答案为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O,酯化反应(或取代反应);
CH3COOC2H5+H2O,酯化反应(或取代反应);
(3)由上述分析可知,D为环氧乙烷,结构简式为 ,其同分异构体的结构简式为CH3CHO等,
,其同分异构体的结构简式为CH3CHO等,
故答案为: ;CH3CHO;
;CH3CHO;
(4)在A、B、C、E、F中,A、E含有羟基、B含有羧基,均能与Na反应,不能与金属钠反应的是 CF,故答案为:CF;
(5)F和足量氢氧化钠溶液反应的化学方程式为:CH3COOCH2CH2OOCH3+2NaOH→HOCH2CH2OH+2CH3COONa,
故答案为:CH3COOCH2CH2OOCH3+2NaOH→HOCH2CH2OH+2CH3COONa.
点评 本题考查有机推断,涉及烯烃、醇、醛、羧酸等性质以及学生推理能力等,是对有机化合物知识的综合考查,能较好的考查考生的思维能力,根据乙烯与D的分子式,结合E与乙酸反应生成F,各分子中C原子数目,判断D的结构是解题的关键,难度中等,是高考热点题型.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
| 物质 | 杂质 | 试剂 | 主要操作 |
A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
B | CO2 | CO | O2 | 点燃 |
C | FeCl2溶液 | FeCl3 | Cu | 过滤 |
D | CO2 | SO2 | NaOH溶液 | 洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
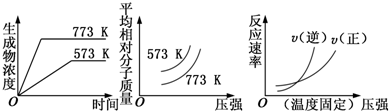
| A. | 该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫 | |
| B. | 达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零 | |
| C. | 一定条件下,向某密闭容器中加入2molSO2和1molO2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等 | |
| D. | 在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (Na+)>c (CN-)>c (HCN)>c (OH-)>c (H+) | |
| B. | 20 mL 0.1 mol/L的Na2CO3溶液与等体积等浓度的盐酸混合充分反应后的溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)=2c(Cl-)=0.1 mol/L | |
| C. | 浓度均为1 mol/L的以下溶液:①醋酸 ②NaOH溶液 ③盐酸 ④醋酸钠溶液,其水的电离程度的关系为:④>①>③>② | |
| D. | 相同温度下,pH值相同的CH3COONa溶液与NaHCO3溶液一定存在关系:c(CH3COO-)=c(HCO3-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g)═2NH3(g)△H<0 | B. | 2SO3(g)?═?2SO2(g)+O2(g)△H>0 | ||
| C. | 4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0 | D. | H2(g)+CO(g)?═?C(s)+H2O(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
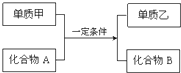 置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 服用铬含量超标的药用胶囊会对人对健康造成危害 | |
| B. | 食用一定量的油脂能促进人体对某些维生素的吸收 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 使用填埋法处理未经分类的生活垃圾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com