



科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省八市高三3月联考化学试卷(解析版) 题型:填空题
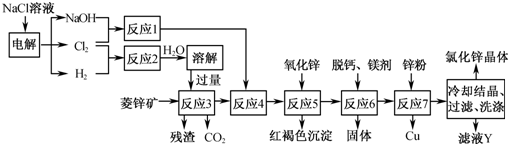
用菱锌矿(主要成分为碳酸锌,还含有Fe2+ 、Fe3+、 Mg2+、 Ca2+ 、Cu2+等)制备氯化锌的一种流程如下:

(1)在反应3前要将菱锌矿研磨,其目的是_______________________________
(2)反应4将Fe2+氧化为Fe3+,该反应的离子方程式为______________________
(3)加入氧化锌调节pH=4.5,反应5的离子方程式为________________________
(4)锌粉不在反应4之前加的原因是____________________________________
(5)若用石墨作电极电解滤液Y,则可以得到参与本流程反应的物质有_________
查看答案和解析>>
科目:高中化学 来源:南京一模 题型:问答题
查看答案和解析>>
科目:高中化学 来源:江苏模拟题 题型:填空题

(1)在反应3前要将菱锌矿研磨,其目的是__________________。
(2)反应4将Fe2+氧化为Fe3+,该反应的离子方程式为______________________。
(3)加入氧化锌调节pH=4.5,反应5的离子方程式为______________________。
(4)锌粉不在反应4之前加入的原因是___________________。
(5)若用石墨作电极电解滤液Y,则可以得到参与本流程反应的物质有____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com