
【题目】已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是( )
A. P—P键的键能大于P—Cl键的键能
B. 可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C. Cl—Cl键的键能为![]() kJ·mol-1
kJ·mol-1
D. P—P键的键能为![]() kJ·mol-1
kJ·mol-1
【答案】C
【解析】A. 原子半径:P>Cl,键长:P—P>P—Cl,键长越长,键能越小,所以P—P键的键能小于P—Cl键的键能,故A错误;B.不知道 PCl5(g)=PCl5(s)的反应热ΔH,所以无法求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH,故B错误;C. 将已知热化学方程式分别用①和②表示,②-①得Cl2(g)+PCl3(g)===PCl5(g) ΔH=(b-a)/4kJ·mol-1,ΔH=反应物键能-生成物键能=Cl—Cl键的键能+3.6ckJ·mol-1-5ckJ·mol-1=(b-a)/4kJ·mol-1,所以Cl—Cl键的键能为![]() kJ·mol-1,故C正确;D. (5①-3②)/2得P4(g)+6PCl5(g)===10PCl3(g) ΔH=(5a-3b)/2kJ·mol-1,ΔH=反应物键能-生成物键能=6P—P键的键能+30ckJ·mol-1-36ckJ·mol-1=(5a-3b)/2kJ·mol-1,所以P—P键的键能为
kJ·mol-1,故C正确;D. (5①-3②)/2得P4(g)+6PCl5(g)===10PCl3(g) ΔH=(5a-3b)/2kJ·mol-1,ΔH=反应物键能-生成物键能=6P—P键的键能+30ckJ·mol-1-36ckJ·mol-1=(5a-3b)/2kJ·mol-1,所以P—P键的键能为![]() kJ·mol-1,故D错误。故选C。
kJ·mol-1,故D错误。故选C。


科目:高中化学 来源: 题型:
【题目】新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。

回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为________________ 、_______________ ;
(2)闭合K开关后,a、b电极上均有气体产生.其中a电极上得到的是_________(填化学式),电解氯化钠溶液的总反应方程式为___________________;
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上最多能产生的氯气体积为____________L(标准状况);
(4)若饱和氯化钠溶液体积为100mL,电解一段时间后,常温下测得溶液pH为13,若要使溶液恢复到电解前的状态,可向溶液中加(或通)入__________(填写物质的化学式)_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。
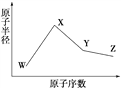
(1)X位于元素周期表中第________周期第________族;W的基态原子核外有_____个未成对电子。
(2)Z的气态氢化物和溴化氢相比,较稳定的是______(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组将SO2通入Na2S和Na2SO3的混合溶液中制备硫代硫酸钠(Na2S2O3)。其装置如下图所示(省略夹持装置),下列说法错误的是
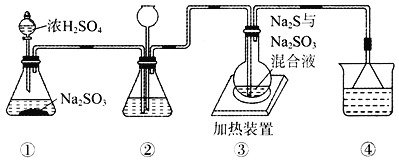
A. 装置②的作用之一是观察SO2的生成速率,其中的液体可以是饱和NaHSO3溶液
B. 为提高产品纯度,使烧瓶中Na2S和Na2SO3恰好完全反应,则![]()
C. 装置④的作用是吸收尾气,同时防止倒吸
D. 装置①也可用于高锰酸钾与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠和碳酸氢钠是生活中常见的物质,请回答下列问题。
(1)碳酸氢钠的俗称是_________,其水溶液显_____性。(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式____________。等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应时生成CO2的量,前者________后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为________________________________。
(4)硫酸亚铁是缺铁性贫血的治疗药物,可用于制备铁盐,实验室检验Fe3+的方法是:向溶液中滴入几滴_________________溶液,观察溶液是否变为血红色。向FeSO4溶液中加入NaOH溶液通常得不到白色的Fe(OH)2沉淀,其原因是_________________________(用化学方程式回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以C2H2为原料合成环丁烯类化合物L的路线如下:
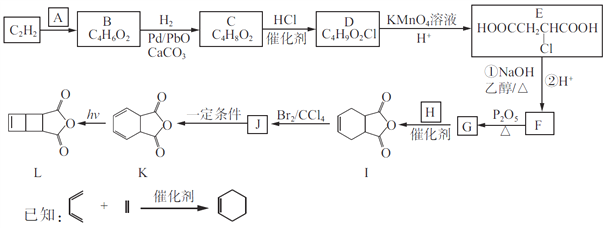
(1)A由碳、氢、氧三种元素组成,相对分子质量是30,则A的名称为____________。
(2)B分子中的碳原子都在同一直线上,B的结构简式为________________。
(3)C→D、J→K的反应类型分别为________________、________________。
(4)设计C→D、E→F两步反应的目的是________________________。
(5)G和H生成I的化学方程式为______________________。
(6)化合物X是I的同分异构体,可与FeCl3溶液发生显色反应,且能与NaHCO3溶液反应放出CO2,X共有__种(不考虑立体异构);其中核磁共振氢谱为五组峰,峰面积比为2:2:2:1:1的结构简式为____________________。
(7)写出用![]() 和乙炔为原料制备
和乙炔为原料制备![]() 的合成路线(其他试剂任选)_____。
的合成路线(其他试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用氯水来制取含有次氯酸的溶液,既要提高溶液中HClO物质的量浓度,又要降低溶液中HCl浓度,下列措施可以采用的是( )
A. 加热挥发HCl B. 加CaSO3
C. 加NaOH中和HCl D. 加CaCO3中和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g) ②2HI(g)
NH3(g)+HI(g) ②2HI(g)![]() H2(g)+I2(g) 达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,,则此温度下反应①的平衡常数为
H2(g)+I2(g) 达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,,则此温度下反应①的平衡常数为
A. 9 B. 16 C. 20 D. 25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物F具有抗肿瘤、降血糖、降血压等多种生物活性,其合成路线如下:
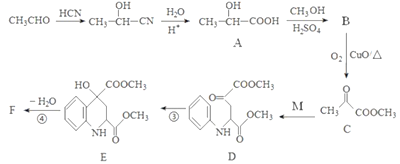
已知:M的结构简式为: 。
。
请回答下列问题:
(1)A的化学名称是______________________。
(2)C中官能团的名称是_________________________。
(3)写出F的结构简式____________________________。
(4)已知A在一定条件下能生成可降解的聚酯,请写出该反应化学方程式:_________________。
(5)满足下列条件的M的同分异构体有_____种(不含立体异构)。
①能够发生银镜反应。
②含有硝基(-NO2),且硝基直接连在苯环上。
③含有苯环且苯环上只有两个取代基。
其中核磁共振氢谱为四组峰且峰面积之比为6:2:2:1的结构简式为______________(写出一种即可)。
(6)写出用乙醛为原料制备高分子化合物聚丙烯腈的合成路线(无机试剂任选):_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com