
下图是某些常见物质之间的转化关系。A、I是金属单质,F、G是非金属单质。已知B的相对分子质量在75~80之间,E是A的氧化物、其相对分子质量为232。请按要求填写下列空白:
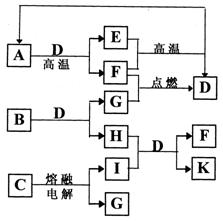
(1)A、B、C代表的物质分别是 , , (填化学式)。
(2)写出B物质的电子式 。
(3)K的水溶液呈碱性,用离子方程式说明其呈碱性的原因 。
(4)写出I→K的离子方程式: 。
(5)当有0.15molA完全反应时,反应中转移电子的物质的量为 。
科目:高中化学 来源: 题型:
请回答下列问题:
(1)SO2的排放是造成酸雨的主要因素。某地区酸雨pH随时间的变化如下图所示。请用化学方程式表示该地区酸雨pH随时间增加而减小的原因______________________________。

(2)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是_______________________________________________________。
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及的化学反应为:SO2+2CO====2CO2+![]() Sx、CO+
Sx、CO+![]() Sx====COS、2COS+SO2====2CO2+
Sx====COS、2COS+SO2====2CO2+![]() Sx。其中COS分子的空间构型为______________。
Sx。其中COS分子的空间构型为______________。
(4)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀。请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为_____________。若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在硝化细菌的作用下将![]() 氧化为
氧化为![]() :
:![]() +2O2====
+2O2====![]() +2H++H2O,然后加入甲醇,
+2H++H2O,然后加入甲醇,![]() 和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式__________________________。
和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)X的化学式为__________________,O的结构简式为__________________。
(2)考虑到综合经济效益,工业生产M时,可采取的措施有__________________(填序号)。
a.使用催化剂 b.适当降低温度
c.选择合适的温度 d.适度增大压强
e.及时分离出产物 f.对原料进行循环利用
g.充分利用反应本身放出的热量 h.工厂地址尽可能选择在交通发达的城市
i.工厂地址可选择在盛产天然气的地区
(3)设备I的名称__________。工业生产中为了节约资源、降低成本和保护环境,常常对某些物质进行循环利用。上述转化关系中能达到该目的的是__________(填序号)。
(4)现有1 mol A参加反应,假设各步均完全反应,生成N的质量为
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省泰安市高三第一轮复习质量检测化学试卷(解析版) 题型:填空题
物质M是一种日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):

(1)写出用惰性电极电解M溶液的离子方程式??????????????????????? 。
(2)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是????????????????? 。
(3)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是??????????????? 。
(4)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是?????????????????????????????????? 。
(5)若A是一种溶液,只可能含有 中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为????????? 。
中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示。由此可知,该溶液中肯定含有的离子及其浓度之比为????????? 。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市石景山区高三上学期期末考试化学试卷(解析版) 题型:填空题
某课外小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如下图所示(部分产物已略去):

(1)写出用惰性电极电解M溶液的离子方程式 。
(2)写出F的电子式 。
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是 。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是 。
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式是 。
(6)若A是一种化肥。实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是 。若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子及其浓度之比为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂,
但膦在水中的溶解度远小于氨,微溶于水。某反应体系中存在下列物质:Cu、H2SO4、
CuSO4、PH3、H3PO4、H2O。回答下列问题:
①上述反应体系中化学反应方程式为 ;
②膦(PH3)在水中的溶解度远小于氨的原因是 。
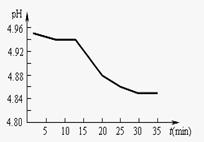 (2)SO2的排放是造成酸雨的主要因素。某地区酸雨
(2)SO2的排放是造成酸雨的主要因素。某地区酸雨
pH随时间的变化如下图所示。请用化学方程式
表示该地区酸雨pH随时间增加而减小的原因
。
(3)生活污水中含大量细小的悬浮物,可加入某些
物质使之聚集成较大的颗粒而沉淀。请你举一
种常见的能使生活污水中悬浮物聚沉的物质,
其化学式为 。若生活污水中含
大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将
NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化
为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
(4)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2
若1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com