
| 混合物 | 分离方法 | 操作过程 | |
| 1 | 从草木灰中提取可溶性物质 | 溶解、过滤 | 将草木灰溶于热水中,不断搅拌, 然后过滤.若滤液仍浑浊,再过滤 |
| 2 | KNO3和NaCl混合物 | 结晶、过滤 | 将混合物溶于热水配成饱和溶液降温,溶液中有KNO3晶体析出,冷却过滤 |
| 3 | 由乙醇溶液制无水乙醇 | 蒸馏 | 加入一定量的生石灰,然后蒸馏 |
| 4 | 除去淀粉溶液中的碘化钠 | 渗析 | 将混合液放入半透膜袋中,并放入流动的蒸馏水中 |
分析 过滤分离可溶物和不溶物,氯化钠的溶解度受温度的影响变化不大,生石灰能与水反应生成难挥发的氢氧化钙,淀粉不能透过半透膜.
解答 解:1.过滤分离可溶物和不溶物,将草木灰溶于热水中,不断搅拌,然后过滤.若滤液仍浑浊,再过滤;
2.氯化钠的溶解度受温度的影响变化不大,将混合物溶于热水配成饱和溶液降温,溶液中有KNO3晶体析出,冷却过滤;
3.生石灰能与水反应生成难挥发的氢氧化钙,加入一定量的生石灰,然后蒸馏;
4.淀粉不能透过半透膜,可用渗析的方法分离,将混合液放入半透膜袋中,并放入流动的蒸馏水中,故答案为:
| 混合物 | 分离方法 | 操作过程 | |
| 1 | 从草木灰中提取可溶性物质 | 溶解、过滤 | 将草木灰溶于热水中,不断搅拌, 然后过滤.若滤液仍浑浊,再过滤 |
| 2 | KNO3和NaCl混合物 | 结晶、过滤 | 将混合物溶于热水配成饱和溶液降温,溶液中有KNO3晶体析出,冷却过滤 |
| 3 | 由乙醇溶液制无水乙醇 | 蒸馏 | 加入一定量的生石灰,然后蒸馏 |
| 4 | 除去淀粉溶液中的碘化钠 | 渗析 | 将混合液放入半透膜袋中,并放入流动的蒸馏水中 |
点评 本题考查物质的分离、提纯和除杂等问题,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | NH3+H2O?NH3•H2O | B. | 3Cl2+8NH3═N2+6NH4Cl | ||
| C. | 3CuO+2NH3 $\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O | D. | NH3+HNO3═NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气分子的电子式: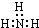 | B. | S2-的结构示意图: | ||
| C. | CH4的球棍模型示意图为: | D. | 用电子式表示HCl形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
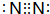 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3与氢碘酸溶液反应Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 电解MgCl2溶液Mg2++2H2O+2Cl-═Mg(OH)2↓+Cl2↑+H2 | |
| C. | Zn与氯化铵溶液反应生成气体Zn+2NH4+═Zn2++4H2↑+N2↑ | |
| D. | 向明矾的水溶液中滴加足量Ba(OH)2溶液Al3++SO42-+Ba2++4OH-═AlO2-+BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
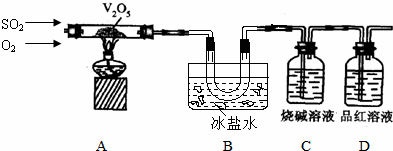
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
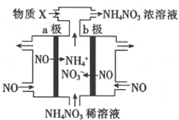 电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,通入物质X.下列说法不正确的是( )
电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,通入物质X.下列说法不正确的是( )| A. | a极接电源的负极 | |
| B. | 阳极反应为:NO-3e-+2H2O=NO3-+4H+ | |
| C. | 阴极反应为:NO+5e-+6H+=NH4++H2O | |
| D. | X为NH3最终制得3molNH4NO3理论上需补充2molX物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol S(g)与1 mol O2(g) 的总能量比1 mol SO2(g)的总能量低QkJ | |
| B. | 1mol S(g) 与1 mol O2(g) 反应生成1 mol SO2(g)放出Q kJ的热量 | |
| C. | S(s)+O2(g)=SO2(g)△H<-Q kJ•mol-1 | |
| D. | 1个S(g)与1个O2(g) 完全反应可以放出Q kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com