
| A. | 通入足量溴水中 | B. | 在空气中燃烧 | ||
| C. | 通入酸性高锰酸钾溶液中 | D. | 通入水中 |
分析 乙烯含有C=C官能团,能与溴水发生加成反应,能被酸性高锰酸钾溶液氧化,注意除杂时不能引入新的杂质,且不能影响被提纯的物质.
解答 解:A.通入溴水中,乙烯与溴水发生加成反应生成二溴乙烷,溴水褪色,既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯,故A正确;
B.在空气中燃烧不能将乙烷中的乙烯除去,故B错误;
C.通入酸性高锰酸钾溶液中,但是生成二氧化碳气体,引入新的杂质,故C错误;
D.乙烯和乙烷都不能溶于水,不能将二者鉴别,故D错误.
故选A.
点评 本题考查有机物的鉴别,为高频考点,把握物质的性质、性质差异、有机反应等为解答的关键,侧重分析与应用能力的考查,注意乙烯被高锰酸钾氧化生成二氧化碳及除杂的原则,题目难度不大.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | NO2、SO2、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 | |
| B. | NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 | |
| C. | 在同一能级上运动的电子,其运动状态可能相同 | |
| D. | 若ABn的中心原子A上没有未用于形成共价键的孤对电子,当n=3,则分子结构为三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅的化学性质稳定,常温下不与任何物质反应 | |
| B. | 硅是构成矿物和岩石的主要元素,硅元素在地壳中的含量居第一位 | |
| C. | 硅在自然界中可以以游离态存在 | |
| D. | 高纯度的单质硅被广泛用于制作计算机芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钙、消石灰、CaO | B. | 氢氧化钠、烧碱、NaOH | ||
| C. | 碳酸钙、熟石灰、CaCO3 | D. | 碳酸钠、小苏打、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
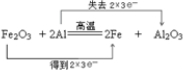 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,电子占据的最高能层具有的原子轨道数为16.
,电子占据的最高能层具有的原子轨道数为16.| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 其一种同位素,可被用作相对原子质量的标准 |
| Y | 其最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应 |
| P | 是短周期中(除稀有气体外)原子半径最大的元素 |
| Q | 存在质量数为25,中子数为13的核素 |
| W | 位于周期表第13列 |
| R | 与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质会出现钝化现象 |
| 化合物 | X3Y4 | R2T2 |
| 晶体类型 | ||
| 熔点/℃ | >3600 | -76 |
 ,用化学方程式表示P2R溶液在空气中的变质过程4Na2S+O2+2H2O═4NaOH+2Na2S2.
,用化学方程式表示P2R溶液在空气中的变质过程4Na2S+O2+2H2O═4NaOH+2Na2S2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com