
【题目】用特殊的方法把固体物质加工到纳米级的超细粉末粒子,然后制得纳米材料。下列分散系中分散质的微粒直径和这种粒子具有相同数量级的是
A. 溶液 B. 悬浊液 C. 胶体 D. 乳浊液
 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A.![]() mol·L-1 B.
mol·L-1 B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1 D.
mol·L-1 D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学电源的说法不正确的是( )
A.我们可以根据硫酸密度的大小来判断铅蓄电池是否需要充电
B.燃料电池是利用燃料和氧化剂之间的氧化还原反应,将化学能转化为热能,然后再转化为电能的化学电源
C.普通锌锰干电池中,发生氧化还原反应的物质大部分被消耗后,就不能再使用了
D.由Ag2O和Zn形成的碱性银锌纽扣电池,发生电化学反应时,Zn作为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaHCO3和Na2O2的固体混合物x g在密闭容器中加热至250℃,充分反应后排出气体.将反应后的固体溶入水无气体放出,再逐滴加入盐酸,产生气体(标准状况)与所加盐酸体积之间的关系如图所示.下列说法错误的是( )
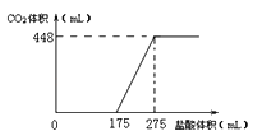
A.HCl的浓度0.2mol/L
B.反应后固体的成分为NaOH与Na2CO3
C.密闭容器中排出气体的成分为O2和H2O
D.x的数值为6.09
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使10 mL浓度为1 mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的量的是( )
A.KNO3
B.CH3COONa
C.CuSO4
D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.05molL﹣1 KOH溶液滴定 10.00mL0.05molL﹣1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法正确的是( )
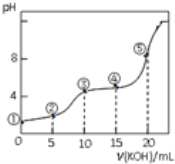
A.点②溶液中:c(K+)+c(H+)=c(HC2O4﹣)+c(C2O42﹣)+c(OH﹣)
B.点③溶液中:c(K+)=c(HC2O4﹣)+c(C2O42﹣)+2c(H2C2O4)
C.点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.05 molL﹣1
D.点⑤溶液中:c(K+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】⑴如图是“×××”牌饮用矿泉水标签的部分内容。
××× (饮用矿泉水) 净含量:350mL 配料表:纯净水、硫酸镁、氯化钾 保质期:12个月 主要成分:钾离子(K+):1.0~27.3mg/L 镁离子(Mg2+):0.1~4.8mg/L 氯离子(Cl-):10~27.3mg/L 硫酸根离子(SO42-):0.4~19.5mg/L |
请认真阅读标签内容,计算:
①镁离子的物质的量浓度的最大值为_____________。
②一瓶合格的这种矿泉水中SO42-的物质的量不能超过_______ 。
⑵某物质A在一定条件下加热分解,产物都是气体,分解方程式为:2A![]() B↑+2C↑+2D↑。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为__________。
B↑+2C↑+2D↑。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在VL密闭容器中,A、B、C三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
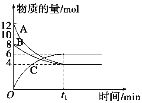
(1)反应的化学方程式为__________________。
(2)从开始到t1 min末时,用物质C表示的反应速率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH不稳定、易分解、在氯气中能燃烧,与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是2Cu+= Cu2++Cu。根据以上信息回答:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是____________。
(2)写出CuH在氯气中燃烧的化学反应方程式________________________。
(3)CuH溶解在稀盐酸中生成的气体是______________,如果反应中生成了标准状况下22.4 L的气体,被还原的离子得电子的物质的量是__________。
II:用高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。
(1)工业上,ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,则化学反应方程式为__________________________。
(2) 有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示。则ClO2的有效氯含量是___________。
(3)某同学欲对用ClO2消毒过的自来水进行氯元素含量的测定(假定ClO2全部转化为Cl-),他进行了如下实验:向30.00 mL水样中加几滴K2CrO4溶液作指示剂,用0.001 mol·L-1 AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达滴定终点,此时用去AgNO3溶液12.12 mL。
①水样中Cl-的物质的量浓度是__________。
②已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。如在滴定终点时,测得溶液中CrO42-的浓度是5.0×10-3mol·L-1。试计算此时溶液中Cl-的浓度是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com