
分析 (1)根据Fe2+氧化会生成成Fe3+,即检验Fe3+的存在;
(2)MnO4-具有氧化性能将Fe2+氧化生成Fe3+,自身被还原成Mn2+,根据化合价升降总数相等、质量守恒以及电荷守恒配平;
(3)①根据仪器的结构和用途来解答;根据滴定管的结构、精确度以及测量原理来解答;
②酸性KMnO4溶液为紫红色,滴定终点时无色变为紫红色;
③根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
④根据关系式:MnO4-~5Fe2+,利用KMnO4的物质的量来求出1000.00mL溶液含有的Fe2+的物质的量,然后求出Fe2+ 的氧化率来解答.
解答 解:(1)Fe2+氧化会生成成Fe3+,可用硫氰化钾溶液检验Fe3+的存在,溶液变成血红色;
故答案为:硫氰化钾溶液;
(2)MnO4-具有氧化性能将Fe2+氧化生成Fe3+,自身被还原成Mn2+,反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;
故答案为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;
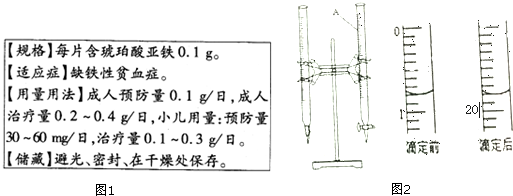
(3)①仪器A的名称是酸式滴定管;滴定管滴定前后读数为:0.80mL,19.80mL,消耗KMnO4溶液体积为19.80mL-0.80mL=19.00mL;
故答案为:酸式滴定管;19.00mL;
②KMnO4溶液呈紫红色,草酸反应完毕,滴入最后一滴KMnO4溶液,溶液由无色变为紫红色,且半分钟不褪色为滴定到终点,
故答案为:滴入最后一滴KMnO4溶液,溶液由无色变为紫红色,且半分钟不褪色;
③A.滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出,待测液的物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏小,故A正确;
B.滴定前俯视,滴定后仰视(标准液),造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,故B错误;
C.滴定接近终点时,用少量蒸馏水冲洗瓶内壁,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)不变,故C错误;
D.未用标准KMnO4溶液润洗滴定管,溶液被稀释,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,c(待测)偏大,故D错误;
故选A.
④由MnO4-~5Fe2+,可得1000.00mL溶液含有的Fe2+的物质的量n(Fe2+)=0.01mol/L×19.00×10-3L×$\frac{1000.00mL}{20.00mL}$×5=0.0475mol,m(Fe2+)=0.0475mol×56g/mol=2.66g,Fe2+的氧化率$\frac{20.00g×20.00%-2.66g}{20.00g×20.00%}$=33.5%>10%,所以不可以服用;
故答案为:不可以.
点评 本题主要考查氧化还原滴定,增加了学生分析问题的能力,强调了学生整合知识的能力,本题难度中等.


科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子 | |
| B. | 食用地沟油对人体的危害极大,原因主要是里面含有黄曲霉素和甘油三酯 | |
| C. | 地球上CH4、CO2等气体含量上升容易导致温室效应,进而引发灾难性气候 | |
| D. | 保鲜膜、一次性食品袋的主要成分是聚氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 实验目的 | 温度/℃ | 催化剂 质量/g | 反应物初始浓度 /10-3mol•L-1 | |
| H2 | I2 | ||||
| Ⅰ | 为以下实验作参照 | 457 | 0 | 7 | 9 |
| Ⅱ | ① | 420 | ② | 7 | 9 |
| Ⅲ | 探究催化剂对该反应速率的影响 | ③ | 10 | 7 | 9 |
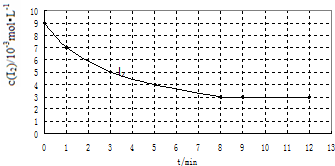
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
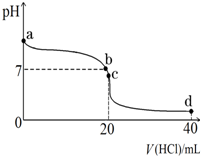 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 22.62 | 20.00 |
| 2 | 22.72 | 20.00 |
| 3 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
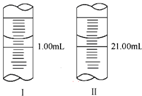 分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.
分析化学常用草酸钠晶体(Na2C2O4溶液无色)作为基准物质测定酸性KMnO4溶液的浓度.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al还原性依次增强 | |
| B. | HCl、PH3、H2S稳定性依次减弱 | |
| C. | NaOH、KOH、Ca(OH)2碱性依次减弱 | |
| D. | S2-、Cl-、K+、Ca2+离子半径依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com