
【题目】锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患。某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如下图所示。
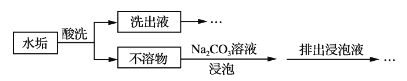
(1)“酸洗”时,一般不选用稀硫酸的原因是_______________________________。
(2)“不溶物”用碳酸钠溶液浸泡的目的是________________________________(用离子方程式表示)。
(3)为防止洗出液中的Fe3+腐蚀铁质管道,常在洗出液中加入SnCl2溶液,反应中Sn2+转化为Sn4+,则Sn2+与Fe3+反应的物质的量之比为________。
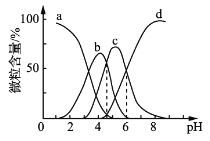
(4)柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是_____________________(用平衡移动原理解释)。HR2-电离常数为Ka3,请根据图示信息计算出pKa3=________(pKa3=-lgKa3)。
(5)利用如图2所示装置对锅炉水(含Ca2+、Mg2+、HCO3—)进行预处理,可有效防止锅炉水垢的形成。写出电解过程中,Ca2+形成沉淀的电极反应方程式:______________________________。

【答案】稀硫酸与碳酸钙反应会生成微溶物硫酸钙,覆盖在反应物表面,阻止反应进一步进行CaSO4+CO32—![]() CaCO3+SO42—1∶2随溶液pH增大,平衡H3R
CaCO3+SO42—1∶2随溶液pH增大,平衡H3R![]() H2R-+H+向右移动,故H3R的百分含量减小62Ca2++2HCO3—+2e-===2CaCO3↓+H2↑或2H2O+2e-===H2↑+2OH- Ca2++OH-+HCO3—==CaCO3↓+H2O
H2R-+H+向右移动,故H3R的百分含量减小62Ca2++2HCO3—+2e-===2CaCO3↓+H2↑或2H2O+2e-===H2↑+2OH- Ca2++OH-+HCO3—==CaCO3↓+H2O
【解析】
(1)若使用稀硫酸会生成微溶物硫酸钙,会沉在反应物的表面,使反应物不能完全反应故不能选硫酸,故答案为:稀硫酸与碳酸钙反应会生成微溶物硫酸钙,覆盖在反应物表面,阻止反应进一步进行;
(2)在水垢进行酸化之后,只有硫酸钙是不溶物,加入碳酸钠,可生成溶解度更小的碳酸钙,故答案为:CaSO4+CO32-![]() CaCO3+SO42-;
CaCO3+SO42-;
(3)Fe3+具有氧化性可以与具有还原性的铁反应生成亚铁离子,会腐蚀铁质管道.据得失电子总数相等的原则,两摩尔的三价铁离子,变成亚铁离子,总共得到两摩尔的电子,所以一摩尔Sn2+转化为Sn4+,则Sn2+与Fe3+反应的物质的量之比为1:2;
(4)H3R![]() H2R-+H随着PH值的增大,氢离子浓度会减小,平衡向右移动,所以H3R含量会减少。由坐标图可知当溶液的pH=6时,溶液中c(R3-)=c(HR2-),由电离平衡常数的表达式可得Ka3=6;故答案为:随溶液pH增大,平衡H3R
H2R-+H随着PH值的增大,氢离子浓度会减小,平衡向右移动,所以H3R含量会减少。由坐标图可知当溶液的pH=6时,溶液中c(R3-)=c(HR2-),由电离平衡常数的表达式可得Ka3=6;故答案为:随溶液pH增大,平衡H3R![]() H2R-+H+向右移动,故H3R的百分含量减小;6;
H2R-+H+向右移动,故H3R的百分含量减小;6;
(5)电解锅炉水实际上就是电解水,水电离出的氢离子在阴极放电,故阴极附近氢氧根浓度偏大,与锅炉水中的镁离子生成沉淀,同时与溶液中的碳酸氢根离子反应生成碳酸根离子,从而与钙离子结合生成碳酸钙沉淀,故答案为:2Ca2++2HCO3—+2e-===2CaCO3↓+H2↑或2H2O+2e-===H2↑+2OH- Ca2++OH-+HCO3—==CaCO3↓+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:

查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-,自身被还原为Bi(OH)3固体。
ii.
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |

回答下列问题:
(1)将铬铁矿矿石粉碎的目的是________________________________________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式_____________________________________________。
(4)⑤中酸化是使CrO42-转化为Cr2O72-![]() 写出该反应的离子方程式______。
写出该反应的离子方程式______。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强碱性的无色透明溶液中,能大量共存的离子组是( )
A.K+、Na+、SO42-、CO32-B.Mg2+、NH4+、NO3-、Cl-
C.Ba2+、K+、Cu2+、Cl-D.Na+、Ag+、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用莫尔盐[化学式为(NH4)xFe(SO4)2·6H2O(Fe为+2价)]测定KMnO4溶液的物质的量浓度的过程如下:
①称取19.6g莫尔盐配成100 mL溶液。
②量取10.00 mL KMnO4溶液,向其中加入足量的H2SO4进行酸化,向酸化后的溶液中逐滴滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液的体积为20.00 mL。所发生反应的离子方程式如下:H++Fe2++MnO4-![]() Fe3++Mn2++H2O(未配平)
Fe3++Mn2++H2O(未配平)
(1)(NH4)xFe(SO4)2·6H2O中x=____,溶液中c(Fe2+)=___mol·L-1。
(2)第①步实验中所需的玻璃仪器除量筒、烧杯、胶头滴管外,还有___。
(3)由第②步实验的反应可知还原性:Fe2+___(填“>”或“<”)Mn2+。
(4)计算KMnO4溶液的物质的量浓度,写出计算过程。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是合成药物“银屑灵”的中间体,其合成流程如下:

(1)化合物C中含氧官能团的名称为________、________。
(2)D→E的反应类型为________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式:____________________。
①不能发生银镜反应;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中有4种不同化学环境的氢。
(4)化合物B的分子式为C10H14O,写出B的结构简式:________________。
(5)已知: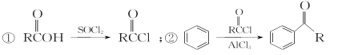 以苯甲醇、乙醛为原料制备
以苯甲醇、乙醛为原料制备![]() ,写出相应的合成路线流程图________________ (无机试剂任用,合成路线流程图示例见本题题干)。
,写出相应的合成路线流程图________________ (无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W、X、Y、Z原子的最外层电子数之和为21,下列说法中不正确的是

A. 原子半径:X>Y>W
B. 简单阴离子的还原性:Z>W
C. 气态氢化物的稳定性:W>Y
D. 氧化物对应水化物的酸性:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是
A. 0.1 mol·L1 Na2S溶液与0.1 mol·L1 NaHS溶液等体积混合:3c(Na+)2c(HS)=2c(S2)+2c(H2S)
B. 向20 mL 0.1 mol·L1 NH4HSO4溶液中滴入0.1 mol·L1 NaOH溶液 20 mL:2c(![]() )=c(NH3·H2O)+c(
)=c(NH3·H2O)+c(![]() )
)
C. 10 mL 0.1 mol·L1 CH3COONa溶液与6 mL 0.2 mol·L1盐酸混合:c(Cl)>c(Na+)>c(OH)>c(H+)
D. 0.2 mol·L1 NaHCO3溶液和0.1 mol·L1 NaOH溶液等体积混合:3c(![]() )+6c(H2CO3)c(Na+)=3c(OH)3c(H+)
)+6c(H2CO3)c(Na+)=3c(OH)3c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源危机是当前全球问题,开源节流是应对能源危机的重要举措。
(1)下列做法有助于能源“开源节流”的是________(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。

在通常状况下,金刚石和石墨中________(填“金刚石”或“石墨”)更稳定.
(3)二甲醚又称甲醚,简称DME,熔点为-141.5℃,沸点为-24.9℃。二甲醚与液化石油气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
a.CO(g)+2H2(g)![]() CH3OH(g) △H1= -90.0 kJ·mol-1
CH3OH(g) △H1= -90.0 kJ·mol-1
b.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l
回答下列问题:
①反应a在__________ (填“低温”或“高温”)下易自发进行。
②写出由合成气(CO、H2) 直接制备二甲醚的热化学方程式:__________________________________。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是__________, 阳极电极反应为__________________________________________________。
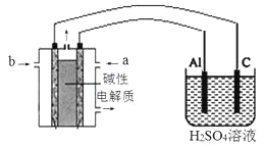
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是![]()
![]()
A. 混合物:水玻璃、碱石灰、明矾 B. 酸:稀硫酸、次氯酸、硫酸氢钠
C. 酸性氧化物:![]() 、
、![]() 、
、![]() D. 碱性氧化物:CaO、
D. 碱性氧化物:CaO、![]() 、
、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com