

| ||
| ||
| 21g |
| 84g/mol |
| 0.15mol |
| 0.2L |


科目:高中化学 来源: 题型:
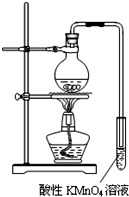 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.| 醇 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是7个基本物理量之一 |
| B、18 g水在标准状况下的体积约为22.4 L |
| C、27 g Al约含有6.02×1023个铝原子 |
| D、配制0.1 mol/L的NaCl溶液需NaCl固体的质量为5.85 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属性:X<Z |
| B、原子半径:X<W<Z<Y |
| C、最高价氧化物对应水化物的酸性:W<Z |
| D、单质Y常温下能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②③ |
| C、①②④ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2SO4 |
| △ |
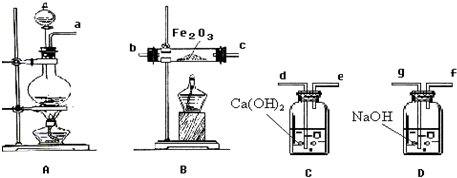
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②③④① |
| C、②①③④ | D、②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com