
 .
. 分析 (1)氯气和氢氧化钙反应生成氯化钙和次氯酸钙;
(2)氯气和浓氨水反应生成氮气和氯化铵;
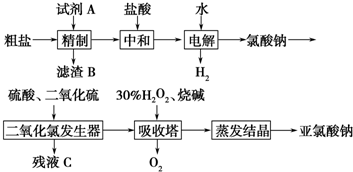
(3)根据反应流程可知,反应1为氯酸钠在酸性条件下被二氧化硫还原成ClO2,根据元素守恒和电荷守恒写离子方程式;
(4)①亚铁离子具有还原性,能与氯气反应,检验铁离子可以利用硫氰化钾溶液;
②用氢氧化钠溶液吸收的是氯气,不用考虑防倒吸.
解答 解:(1)氯气与熟石灰反应生成氯化钙、次氯酸钙和水,化学反应为2Cl2 +2Ca(OH)2=Ca(ClO)2 +CaCl2 +2H2O,
故答案为:2Cl2 +2Ca(OH)2=Ca(ClO)2 +CaCl2 +2H2O;
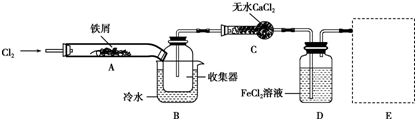
(2)氯气具有强氧化性,可与KI溶液、FeCl2溶液发生氧化还原反应,反应的离子方程式为2I-+Cl2═I2+2Cl-,2Fe2++Cl2═2Fe3++2Cl-,氯气和浓氨水反应生成氮气和氯化铵,反应方程式为8NH3+3Cl2=N2+6NH4Cl,
故答案为:2I-+Cl2═I2+2Cl-或2Fe2++Cl2═2Fe3++2Cl-;3Cl2+8NH3═6NH4Cl+N2或3Cl2+2NH3═6 HCl+N2;
(3)根据反应流程可知,反应1为氯酸钠在酸性条件下被二氧化硫还原成ClO2,反应的离子方程式为2ClO3-+SO2═2ClO2+SO42-,
故答案为:2ClO3-+SO2═2ClO2+SO42-;
(4)①亚铁离子具有还原性,所以氯化亚铁的作用是吸收Cl2,故答案为:吸收Cl2;
②用氢氧化钠溶液吸收的是氯气,不用考虑防倒吸,图为 ,故答案为:
,故答案为: .
.
点评 本题综合考查氯气的性质和应用,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023个 | |
| B. | 含1 mol FeCl3的FeCl3饱和溶液完全反应可以生成1mol Fe(OH)3胶体粒子 | |
| C. | 11.2L二氧化碳气体中所含的分子数为0.5NA | |
| D. | 国际上规定,0.012kg碳原子所含有的碳原子数目为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N×10-2mol•L-1 | B. | $\frac{N}{1.024×1{0}^{22}}$mol•L-1 | ||
| C. | $\frac{N}{6.02×1{0}^{21}}$mol•L-1 | D. | $\frac{N}{6.02×1{0}^{25}}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ③④⑤⑥ | D. | 除①②外 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| Y | H2O | SiO2 | Fe2O3 | Na2CO3 |
| W | NaOH | CO | Al2O3 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法, 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 分子式为C5H12O且氧化产物能发生银镜反应的醇有6种 | |
| C. | 肌醇  与葡萄糖 与葡萄糖 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. | 总物质的量一定时,乙炔和乙醛以任意比混合,完全燃烧消耗氧气量不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com