
浓硫酸的性质有:①酸性、②强氧化性、③脱水性、④难挥发性等。乙醇、溴化钠和浓硫酸混合共热制备溴乙烷时,会有多个副反应发生,此过程中浓硫酸显示的性质是
| A.①②③④ | B.①和② | C.只有① | D.①和④ |
科目:高中化学 来源: 题型:单选题
多数自来水是采用氯气消毒的,为检验自来水中Cl–的存在,最好选用下列物质中的 ( )
| A.石蕊试液 | B.四氯化碳 | C.氢氧化钠溶液 | D.硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水
| A.①②③ | B.②③④ | C.③ | D.③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验:
实验一:向盛有饱和氯水的锥形瓶中加入大理石,并充分振荡,观察到氯水的黄绿色褪去并同时产生少量气体。
实验二:取上述实验一后锥形瓶中清液,进行如下实验:
①该清液滴在有色布条上有极强的漂白作用。②该清液中滴加碳酸钠溶液产生白色沉淀。③该清液中滴加盐酸可产生大量气体。④该清液加热后变浑浊并产生大量气体。
回答下列问题:
(1)在实验二中,清液滴在有色布条上有极强的漂白作用说明该清液中含有______________(写化学式);清液中滴加碳酸钠溶液产生白色沉淀说明该清液中含有______离子;清液中滴加盐酸产生的气体是________;清液加热后产生浑浊的原因是因为生成了________。
(2)该学生通过上述实验,写出氯水和碳酸钙反应的化学方程式为:
。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
科学家发现微量硫化氢可以调节心血管功能。有关硫化氢的叙述正确的是
| A.硫化氢很稳定,受热难分解 |
| B.将硫化氢通入氯水中,氯水褪色并产生浑浊 |
| C.硫化氢在足量氧气中燃烧生成淡黄色固体 |
| D.硫化氢是弱电解质,其电离方程式是H2S ? 2H+ + S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图所示的是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将硫酸滴入装有亚硫酸钠固体的培养皿。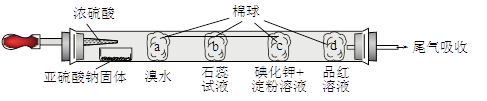
关于此实验的“现象”、“解释或结论”以及对应关系均正确的是
| 选项 | 现象 | 解释或结论 |
| A | a处黄色褪去 | 非金属性:Br>S |
| B | b处变为红色 | 二氧化硫与水反应生成酸性物质 |
| C | c处变为蓝色 | 二氧化硫具有一定的氧化性 |
| D | d处红色先褪去后恢复 | 二氧化硫具有漂白性且漂白性不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某化学小组用下图所示装置制取氯气,下列说法不正确的是
| A.该装置图中至少存在两处明显错误 |
| B.烧瓶中的MnO2可换成KMnO4 |
| C.在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 |
| D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
叠氮酸钠(NaN3)是无色离子晶体,遇高温或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一。下列有关说法正确的是
| A.NaN3中只含有离子键 |
| B.1molNaN3完全分解最多可以产生33.6LN2 |
| C.NaN3快速分解时,NaN3既是氧化剂,又是还原剂 |
| D.常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
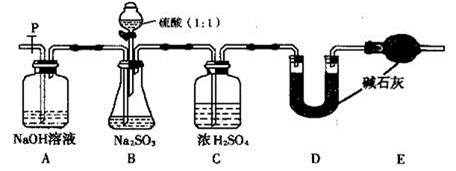
(17分)Na2SO3固体在空气中久置容易变质 。
(I)Na2SO3固体在空气中变质的主要原因,用化学方程式表示为 。
(II)为探究Na2SO3样品的变质情况,现提出以下假设:
假设1:Na2SO3样品完全变质; 假设2:Na2SO3样品完全没有变质;假设3: 。
补充完成以下实验过程及现象和结论,完成探究。
| 实验操作 | 现象和结论 |
| 步骤1:取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加H2SO4酸化的KMnO4溶液; | 现象:若KMnO4溶液的紫红色褪为无色 ①结论:样品中有 离子,假设1不成立。 ②褪色的离子方程式为: 。 |
| 步骤2:另取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加稀HCl,使溶液呈酸性,再滴加适量BaCl2溶液; | ③现象:若 ; 结论:假设2成立。 |
| …… | …… |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com