
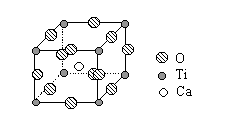
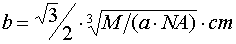
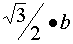 。
。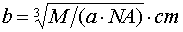 ,
,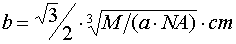 。
。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源:不详 题型:判断题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.含离子键的晶体一定是离子晶体 |
| B.离子晶体一定不含共价键 |
| C.Na2O和SiO2晶体中都不存在单个小分子 |
| D.冰醋酸晶体与冰熔化时需要克服的粒子间作用力类型相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若X是原子晶体,Y是分子晶体,则熔点:X<Y |
| B.若A2+2D-===2A-+D2,则氧化性:D2>A2 |
| C.若R2-和M+的电子层数相同,则原子序数:R>M |
| D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
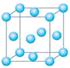
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.PCl5中所有的原子都满足最外层8电子结构 |
| B.同素异形体之间的转化属于物理变化 |
| C.质子数相等,电子数也相等的良种微粒可能是不同的离子 |
| D.CaF2和Na2O2的化学键和晶体类型均相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
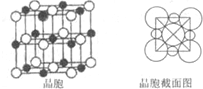
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.活性炭、SO2、氯水都会因发生氧化还原反应而使品红溶液褪色 |
| B.Na2O2、H2O2所含化学键完全相同,都能作供氧剂 |
| C.常温下,浓硫酸、浓硝酸与铝均能发生钝化,均能用铝罐储运 |
| D.水玻璃,从分类法的角度,可看作纯净物,可用于木材等的防火剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com