
下列有关实验的做法错误的是
A.分液时,分液漏斗中的上层液体应由上口倒出
B.用加热的方法可区分碳酸钠和碳酸氢钠两种固体
C.用渗析的方法可除去Fe(OH)3胶体中混有的Cl-
D.加入适量的NaOH可除去NaHCO3溶液中混有的少量Na2CO3
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
某溶液与Al反应能放出H2,下列离子在该溶液中一定能大量共存的是
A.NH4+、Fe2+、NO3-、SO42- B.Na+、K+、Cl-、SO42-
C.Mg2+、H+、Cl-、NO3- D.K+、Ca2+、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
用二氧化氯、铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术,ClO2和Na2FeO4在水处理过程中分别被还原为Cl﹣和Fe3+.
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > >
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3﹣+2Cl﹣+4H+=2ClO2↑+Cl2↑+2H2O
①写出第二步反应的离子方程式
②工业生产时需在反应物中加少量Cl﹣,其作用是
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为﹣59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸在60℃时反应制得,ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请问:
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置
②C中应装的试剂为 C中发生反应的化学方程式为: .
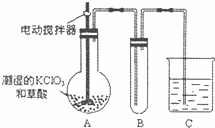
查看答案和解析>>
科目:高中化学 来源: 题型:
为验证氧化性:Cl2>Fe3+>SO2,某
小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
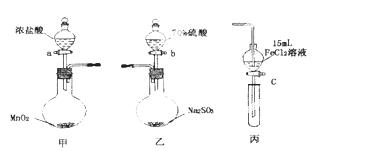
实验步骤:
①在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
②当丙装置中FeC12溶液变黄时,停止加热。
③打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
④在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止。
⑤更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为___________________________________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是__________________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________________________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下:
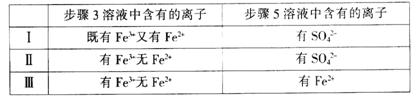
上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是___________(用“I”、“II”、“III”代号回答)。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂_________、_________和一种溶剂__________。
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化。
③如果观察到丙中溶液_______________________________________则结论正确。
④停止通入Cl2。
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进
行如下实验探究。
[实验一]测定硫元素的含量。
Ⅰ、将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2
|
 2Fe2O3+8SO2
2Fe2O3+8SO2 
Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:

|
III、测定铁元素含量的实验步骤如图所示。


问题讨论:
(1)I中,甲瓶内所盛试剂是____溶液。乙瓶内发生反应的离子方程式为____。
(2)II中,乙瓶加入H2O2溶液时反应的离子方程式为_____________________。
(3)该黄铁矿中硫元素的质量分数为_______________________。
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有____________________________________________。
(5)III的步骤④中,表示滴定已达终点的现象是
(6)Ⅲ的步骤④进行了三次平行实验,测得消耗KMnO4溶液体积分别为24.98mL、24.80mL、25.02mL(KMnO4被还原为Mn2+)。根据上述数据,可计算出该黄铁矿样品铁元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是实验室蒸馏石油的实验装置,实验需要收集60~150 ℃和150~300 ℃的馏分。
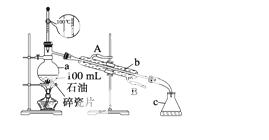
请回答下列问题:
(1)仪器a的规格和名称__________,仪器b、c的名称:b________,c________。
(2)实验所选温度计是错误的,正确的选择应该是_________________________。
(3)实验时在仪器a中加入了少量碎瓷片,其目的是________________________。
(4)实验时在仪器b中通入冷却水,请指明冷却水的流向______________ _____________。
_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
检验SO2气体中是否含有CO2气体应用的方法是
A.通过石灰水 B.先通过酸性KMnO4溶液再通过石灰水
C.通过品红溶液 D.先通过小苏打溶液再通过石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
欲使1L 0.5mol/L的NaOH溶液的浓度增大一倍,可采取的合理措施是
A.加入20g 固体NaOH,搅拌、溶解;
B.将溶液加热浓缩至0.2L;
C.加入10mol/L的NaOH溶液0.1 L,再稀释至1.5 L;
D.加入1 L 1.5 mol/L的NaOH溶液混合均匀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com