
| A. | 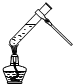 葡萄糖的银镜反应 | B. | 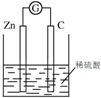 形成原电池 | ||
| C. | 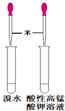 检验苯中有无碳碳双键 | D. | 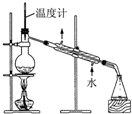 石油的分馏 |
分析 A.银镜反应应采取水浴加热;
B.锌能够与电解质溶液稀硫酸反应,图示装置可写出原电池;
C.含有碳碳双键的有机物能够与溴水发生加成反应,能够与酸性高锰酸钾发生氧化还原反应;
D.蒸馏操作过程中,温度计应该放在蒸馏烧瓶的支管口处,冷凝管采用的是逆向通水法.
解答 解:A.银镜反应应采取水浴加热,直接加热可能为发生爆炸危险,该操作方法不合理,故A正确;
B.图示装置中,锌能够与稀硫酸反应,锌为负极、碳棒为正极,且形成了闭合回路,可以形成原电池,能够达到实验目的,故B错误;
C.溴水能够与碳碳双键发生加成反应、能够被酸性高锰酸钾溶液氧化,可以用溴水和酸性高锰酸钾溶液检验苯中是否含有碳碳双键,能够达到实验目的,故C错误;
D.蒸馏操作过程中,温度计应该放在蒸馏烧瓶的支管口处,冷凝管采用的是逆向通水法,这样使水能够与冷凝管中物质充分接触,冷凝效果好,图示装置合理,能够达到实验目的,故D错误;
故选A.
点评 本题考查对实验装置的理解、分析与评价,题目难度中等,是对实验基础的综合考查,明确实验装置的作用、实验目的及正确操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 混合气通过盛有水的洗气瓶 | |
| B. | 通过装有过量溴水的洗气瓶 | |
| C. | 混合气通过装有酸性高锰酸钾溶液的洗气瓶 | |
| D. | 混合气与过量氢气混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 密闭容器中混和气体的密度不再发生变化 | |
| B. | 混和气体的平均相对分子质量不再发生变化 | |
| C. | 单位时间内生成3mol B的同时有2mol A生成 | |
| D. | A的生成速率与A的分解速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
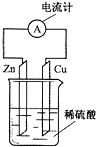
| A. | 锌片为正极,且锌片逐渐溶解 | B. | 铜片为负极,且铜片上有气泡 | ||
| C. | 溶液中的H+移向铜极 | D. | 该装置能将电能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
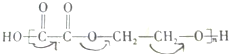 )是一种重要的化工原料,某种由A制备G的工艺流程如下,请回答:
)是一种重要的化工原料,某种由A制备G的工艺流程如下,请回答: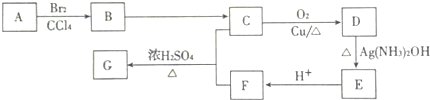
 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,23 g NO2含有0.5NA个氮原子 | |
| B. | 1L 0.1 mol•L-1硫酸铵溶液中含有0.1NA个NH4+ | |
| C. | 常温常压下,22.4 L CCl4含有NA个CCl4分子 | |
| D. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
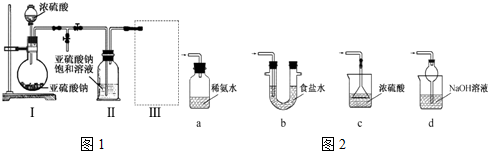

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com