
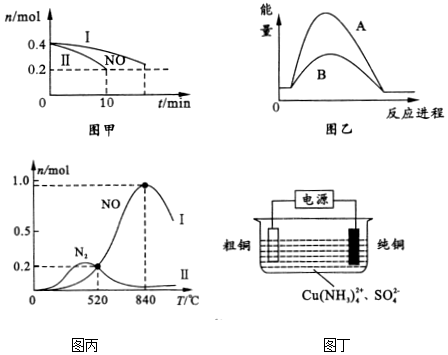
分析 I、催化剂改变活化能影响反应速率
(1)①在汽车尾气排气管口将NO和CO转化成无污染气体生成二氧化碳和氮气;
②l0min内途径II中NO物质的量变化为0.4mol-0.2mol=0.2mol,反应速率v=$\frac{△c}{△t}$;途径Ⅰ达到平衡时间长,途径Ⅱ达到平衡状态需要时间短,A为活化能大,B为活化能小;排气管是敞口容器,管中进行的反应为非平衡状态;
Ⅱ、温度能提高催化剂的选择性
(2)①520℃时反应为4NH3+5O2=2N2+6H2O,4NH3+5O2=4NO+6H2O,计算平衡浓度,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
②工业制备硝酸需要氨气催化氧化生成一氧化氮,一氧化氮和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮;
Ⅲ、催化剂的制备
(3)粗铜提纯过程中做阳极,精铜做阴极,电解质溶液中Cu(NH3)42+得到电子生成铜,结合电极反应和电子守恒计算得到纯铜质量.
解答 解:(1)①在汽车尾气排气管口将NO和CO转化成无污染气体生成二氧化碳和氮气,反应的化学方程式为2NO+2CO?2CO2+N2,
故答案为:2NO+2CO?2CO2+N2;
②l0min内途径II中NO物质的量变化为0.4mol-0.2mol=0.2mol,生成氮气物质的量为0.1mol,l0min内途径II的反应速率v(N2)=$\frac{△c}{△t}$=$\frac{\frac{0.1mol}{2L}}{10min}$=0.005mol/(L•min),途径Ⅰ达到平衡时间长,途径Ⅱ达到平衡状态需要时间短,A为活化能大,B为活化能小,途径I对应图乙中A,汽车尾气排气管口使用催化剂可以提高污染物转化率,是因为排气管是敞口容器,管中进行的反应为非平衡状态,该非平衡条件下,反应速率越快相同时间内污染物转化率越高,
故答案为:0.005mol/(L•min);A;排气管是敞口容器,管中进行的反应为非平衡状态,该非平衡条件下,反应速率越快相同时间内污染物转化率越高;
(2)①520℃时反应 4NH3+5O2=4NO+6H2O
变化量(mol/L) 0.2 0.25 0.2 0.3
520℃时,4NH3+3O2?2N2+6H2O
起始量(mol/L) 1 2 0 0
变化量(mol/L) 0.4+0.2 0.3+0.25 0.2 0.6
平衡量(mol/L) 0.4 1.45 0.2 0.9
反应的平衡常数K的计算表达式为:K=$\frac{0.{9}^{6}×0.{2}^{4}}{0.{4}^{4}×1.4{5}^{3}}$,
故答案为:$\frac{0.{9}^{6}×0.{2}^{4}}{0.{4}^{4}×1.4{5}^{3}}$;
②图象丙分析可知840°C时生成一氧化氮其量最大,工业制备HNO3,选择的最佳温度为840°C,
故答案为:840°C;
(3)粗铜提纯过程中做阳极,精铜做阴极,电解质溶液中Cu(NH3)42+得到电子生成铜,阴极电极反应为:Cu(NH3)42++2e-=Cu+4NH3,在4.825A的电流作用下通电l小时,通过的电量=4.825A×3600s=17370C,通过电子物质的量=$\frac{17370C}{96500C/mol}$=0.18mol,生成获得纯铜物质的量=0.09mol,质量=0.09mol×64g/mol=5.76g,
故答案为:Cu(NH3)42++2e-=Cu+4NH3;5.76.
点评 本题考查了化学平衡影响因素、图象分析判断、化学平衡常数计算、电解原理和电子守恒的计算等,掌握基础是解题关键,题目难度中等.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 固体溶解后立即倒入容量瓶定容 | |
| C. | 滴管加水时超过刻线,用滴管吸出多余的水 | |
| D. | 定容时俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可能有Cl2和O2 | B. | 肯定只有NO | ||
| C. | 肯定有SO2和NO,一定无O2 | D. | 肯定没有Cl2和NO2,一定有O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH | B. | CH3CH2CH2OH | C. | CH3OH | D. | CH3-O-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
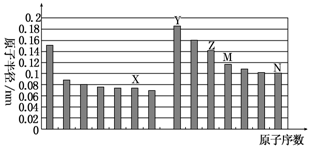
| A. | X、N两种元素的气态氢化物的沸点相比,前者较低 | |
| B. | Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 | |
| C. | 由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 | |
| D. | Z、N两种元素的离子半径相比,前者较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2O2中含有的阴离子数是0.2 NA | |
| B. | 常温常压下,8 g O2含有的电子数是4NA | |
| C. | 标准状况下,2.24 L CCl4中含有的分子数为0.1NA | |
| D. | 1 L 1.0 mol•L-1Na2CO3溶液中含有的氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、Cl-、SO42- | B. | Fe3+、K+、SO42-、NO3- | ||
| C. | Na+、CO32-、OH-、NO3- | D. | Na+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com