
| A. | 硝酸钠 氢氧化钠 | B. | 氧化铜 二氧化锰 | ||
| C. | 氯化钾 碳酸钙 | D. | 硫酸铜 氢氧化钠 |
科目:高中化学 来源: 题型:选择题
| A. | Sn(NO3)4 | B. | Sn(NO3)2 | C. | SnO2?4H2O | D. | SnO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH可用于治疗胃酸过多 | |
| B. | CaO可防止月饼等食品氧化变质 | |
| C. | 氢弹中用到的2H、3H互为同位素 | |
| D. | 向海水中加入净水剂明矾可以使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
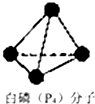 氨是重要的化工原料,用途广泛.
氨是重要的化工原料,用途广泛.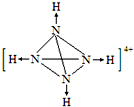 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g氧气与足量锂完全反应得到的电子数为2NA | |
| B. | 在1L2mol•L-1MgCl2溶液中含有的Cl-数为2NA | |
| C. | 标准状态下,2.24LCO2与2.24LH2O中所含原子数均为0.3NA | |
| D. | 标准状况下,11.2L氯气与足量NaOH溶液反应转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
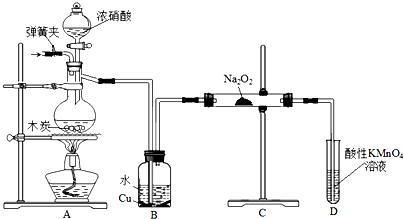
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去): ;D
;D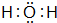 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:填空题
汽车常装有安全气囊,当发生强烈碰撞时,瞬间引发以下反应:2NaN3=2Na+3N2↑,所产生的气体快速充满气囊,可以达到保护车内人员的目的.
(1)若气囊中装有130g NaN3,则其物质的量是_______________.
(2)若130g NaN3完全分解,在标准状况下,气囊膨胀的体积约为_______________.
(3)该反应中的氧化剂是 氧化产物是__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com