
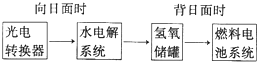
分析 (1)碱性氢氧燃料电池中,负极上氢气失电子和氢氧根离子反应生成水;根据生成气体和转移电子之间的关系式计算;
(2)该电解池中,阴极上二氧化碳得电子和水反应生成CO和氢氧根离子.
解答 解:(1)碱性氢氧燃料电池中,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2-2e-+2OH-=H2O;电解水生成氢气和氧气的体积之比为2:1,则混合气体中生成氧气体积=$\frac{1}{3}×33.6L$=11.2L,转移电子物质的量=$\frac{11.2L}{22.4L/mol}×4$=2mol;
故答案为:H2-2e-+2OH-=H2O;2;
(2)该电解池中,阴极上二氧化碳得电子和水反应生成CO和氢氧根离子,电极反应式为 CO2+2e-+H2O=CO+2OH-,
故答案为:CO2+2e-+H2O=CO+2OH-.
点评 本题以化学电源新型电池为载体考查电极反应式的书写,为高频考点,明确各个电极上发生的反应是解本题关键,注意结合电解质溶液酸碱性书写电极反应式,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Al3+ Ag+ NO3- Cl- | B. | Mg2+NH4+ NO3- I- | ||
| C. | Ba2+K+ S2- Cl- | D. | Zn2+ Na+ NO3- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 相同条件下,与金属钠反应的速率,乙醇比乙酸慢 | |
| C. | 乙醇可由乙烯与水发生加成反应制得,乙酸可由乙醇氧化制得 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应的逆反应为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯银制品在空气中久置变黑,是因为发生了电化学腐蚀 | |
| B. | 氨常用作制冷剂,是因为其沸点极低,易液化 | |
| C. | 酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化 | |
| D. | 明矾具有强氧化性,可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用,利用铝热反应完成钢轨的焊接非常方便迅速.完成下列填空:
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用,利用铝热反应完成钢轨的焊接非常方便迅速.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐卤可用于制作豆腐 | |
| B. | 从海水中提取物质都要通过化学反应才能实现 | |
| C. | 煤经过气化和液化等物理变化可转化为清洁燃料 | |
| D. | 制作航天服的聚醋纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ③④⑤⑥ | B. | ①③④⑤ | C. | ①②③⑥⑦ | D. | ①②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com