

分析 (1)①依据C=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度;
②盐酸溶液中,溶液浓度、溶液密度都与溶液体积大小无关,而氯化氢的物质的量、氯离子数目与溶液体积大小有关;
(2)依据制备浓盐酸用到的试剂及反应条件选择发生装置;
(3)①依据m=CVM计算需要溶质的质量;
②分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)①氧化铁与盐酸反应生成氯化铁和水;
②氯化铁水解生成氢氧化铁胶体和氯化氢;
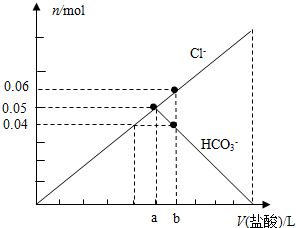
(5)氯离子的物质的量即所加盐酸的物质的量;a点全部生成碳酸氢钠,根据碳守恒,所以含有0.05mol Na2CO3,依据V=$\frac{n}{C}$计算碳酸钠溶液体积.
解答 解:(1)①依据浓盐酸试剂瓶标签上的有关数据可知,浓盐酸的物质的量浓度C=$\frac{1000×1.19×36.5%}{36.5}$=11.9mol/L;
故答案为:11.9mol/L;
②A.溶液中HCl的物质的量大小取决于溶液体积大小和溶液浓度,故A错误;
B.溶液具有均一性,溶液的浓度与溶液体积大小无关,故B正确;
C.溶液中Cl-的数目与溶液浓度、溶液体积大小及溶质化学式组成有关,故C错误;
D.溶液具有均一性,溶液的密度与溶液体积大小无关,故D正确;
故答案为:BD;
(2)实验室用加热浓盐酸与二氧化锰的方法制取氯气,反应为状态为液体+固体,反应条件为加热,所以应选择装置B;
故答案为:B;
(3)①配制500mL 0.16mol/L Na2CO3溶液,需要Na2CO3•10H2O质量=0.5L×0.16mol/L×286g/mol=22.9g;
故答案为:22.9;
②A.加水时越过刻度线,导致溶液体积偏大,溶液浓度偏低;
故答案为:偏低;
B.定容时,仰视容量瓶刻度线,导致溶液体积偏大,溶液浓偏低;
故答案为:偏低;
(4)①氧化铁与盐酸反应生成氯化铁和水,化学方程式:Fe2O3+6H+═2Fe3++3H2O;
故答案为:Fe2O3+6H+═2Fe3++3H2O;
②氯化铁水解生成氢氧化铁胶体和氯化氢,化学方程式:FeCl3+3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3 (胶体)+3HCl;
故答案为:FeCl3+3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3 (胶体)+3HCl;
(5)氯离子的物质的量即所加盐酸的物质的量,而盐酸的物质的量浓度为1mol•L-1,所以b点的数值为0.06;
a点全部生成碳酸氢钠,根据碳守恒,所以含有0.05mol Na2CO3,所取的碳酸钠溶液的体积V=$\frac{0.05mol}{0.16mol/L}$=0.3125L,即312.5mL;
故答案为:0.06;312.5.
点评 本题为综合题,考查了一定物质的浓度溶液的配制、氯气的实验室制备、碳酸钠与盐酸反应的有关计算,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
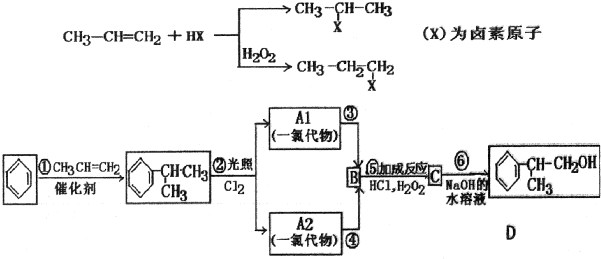
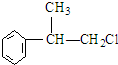 、,
、,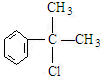 ;
; ,C的结构简式:
,C的结构简式: ;
; +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl;
+NaCl;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应一定只伴随热量的变化 | |
| B. | 凡是吸热或放热过程中热量的变化均称为反应热 | |
| C. | 若△H<0,则反应物的能量高于生成物的能量 | |
| D. | 若△H>0,则反应物的能量高于生成物的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
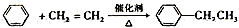

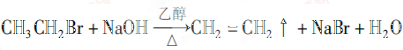 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
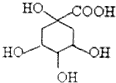 奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中不正确的是( )
奎尼酸是制备艾滋病新药二咖啡酰奎尼酸的原料,其结构简式如图,下列有关奎尼酸的说法中不正确的是( )| A. | 不能使溴的四氯化碳溶液褪色 | |
| B. | 能用碳酸氢钠溶液鉴别奎尼酸和苯 | |
| C. | 1 mol奎尼酸与足量钠反应生成56L氢气 | |
| D. | 与乙醇、乙酸均能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CHCH2CH3和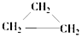 | B. |  和 和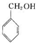 | ||
| C. | 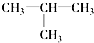 和CH3CH2CH2CH3 和CH3CH2CH2CH3 | D. | CH3CH2Cl与CH3CH2CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 高锰酸钾在酸性介质中与草酸反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8 H2O | |
| C. | FeCl2与K3[Fe(CN)6]反应:2Fe2++3[Fe(CN)6]3-═Fe2[Fe(CN)6]3↓ | |
| D. | 向KI和H2SO4的混合溶液中通入空气:4H++4I-+O2=2I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al3+、Mg2+、SO32- | B. | K+、CO32-、I- | C. | Al3+、CO32-、I- | D. | Na+、Br-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com