
| A. | ①④⑥ | B. | ①②③④ | C. | ①④⑤⑥ | D. | 全部 |
分析 强弱电解质的根本区别是电解质的电离程度,完全电离的电解质是强电解质、部分电离的电解质是弱电解质,要证明亚硝酸是弱电解质,只要能说明亚硝酸部分电离即可,据此分析解答.
解答 解:①常温下NaNO2溶液的pH大于7,说明亚硝酸钠是强碱弱酸盐,则亚硝酸是弱酸,故正确;
②用HNO2溶液做导电实验,灯泡很暗,说明溶液中离子浓度很小,但不能说明亚硝酸部分电离,所以不能证明亚硝酸是弱电解质,故错误;
③HNO2和NaCl不能发生反应,说明不符合复分解反应条件,但不能说明亚硝酸部分电离,所以不能证明亚硝酸是弱电解质,故错误;
④0.1mol•L-1 HNO2溶液的pH=2.1,说明亚硝酸部分电离,则亚硝酸是弱电解质,故正确;
⑤NaNO2和H3PO4反应,生成HNO2,根据强酸制取弱酸知,磷酸酸性大于亚硝酸,磷酸是中强酸,则亚硝酸是弱酸,故正确;
⑥0.1mol•L-1 HNO2溶液稀释至100倍,pH变化值小于2,说明亚硝酸中存在电离平衡,则亚硝酸是弱酸,为电解质,故正确;
故选C.
点评 本题考查强弱电解质判断,为高频考点,明确强弱电解质本质区别是解本题关键,根据电解质电离程度判断电解质强弱,不能根据其水溶液导电性强弱判断,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 2mol | B. | 10mol | C. | 7.5mol | D. | 6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融Al2O3制金属铝,用铁作阳极 | |
| B. | 电解法精炼粗铜,用纯铜作阴极 | |
| C. | 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 | |
| D. | 在镀件上镀锌,用锌用阳极,硫酸锌作电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
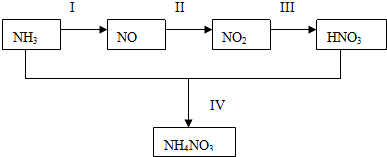
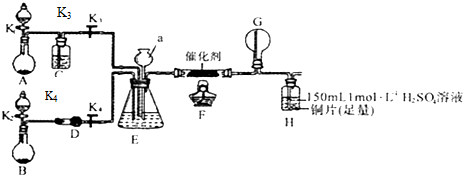
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,可以加快反应速率,缩短可逆反应达到平衡的时间 | |
| B. | 化学反应达到最大限度时,正逆反应速率也达到最大且相等 | |
| C. | 用锌和稀硫酸反应制取H2时,滴加几滴硫酸铜溶液能加快反应速率 | |
| D. | 用铁片和稀硫酸反应制H2比用98%的浓硫酸产生H2的速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 钢钉表面有白色沉淀 | B. | 实验2中的高锰酸钾溶液先变色 | ||
| C. | 负极的电极反应为:Fe-3e-→Fe3+ | D. | 铁钉表面有红褐色物质生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com