
| A. | 酸性HF>HCl>HBr>HI | B. | 热稳定性HI>HRr>HCl>HF | ||
| C. | 非金属性F>Cl>Br>I | D. | 原子半径F>Cl>Br>I |
分析 A.非金属性越强,对应氢化物越稳定,但一般不比较氢化物的酸性;
B.非金属性越强,对应氢化物越稳定;
C.同主族从上到下非金属性减弱;
D.同主族从上到下原子半径增大.
解答 解:A.非金属性F>Cl>Br>I,则热稳定性为HF>HCl>HBr>HI,但HF酸为弱酸,其它为强酸,酸性为HI>HRr>HCl>HF,故A错误;
B.非金属性F>Cl>Br>I,则热稳定性为HF>HCl>HBr>HI,故B错误;
C.同主族从上到下非金属性减弱,则非金属性F>Cl>Br>I,故C正确;
D.同主族从上到下原子半径增大,则原子半径F<Cl<Br<I,故D错误;
故选C.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>HClO | B. | 金属性:Na>Mg | ||
| C. | 碱性:KOH>NaOH | D. | 热稳定性:HC1>HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B>A>C | B. | A>B=C | C. | B>A=C | D. | B>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
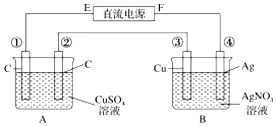 如图所示,通电5min后,第③极增重2.16g,此时CuSO4恰好电解完.设A池中原混合溶液的体积为200mL.
如图所示,通电5min后,第③极增重2.16g,此时CuSO4恰好电解完.设A池中原混合溶液的体积为200mL.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+HCl; K2CO3+HNO3 | B. | Fe+HCl;Fe+H2SO4 | ||
| C. | BaCl2+Na2SO4;Ba(OH)2+H2SO4 | D. | NaOH+H2O;Ba(OH)2+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 操作 |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 验证淀粉已水解 | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 |
| C | 比较Mg和Al的金属活动性强弱 | 分别用镁、铝为电极,氢氧化钠为电解质的原电池装置中反应现象 |
| D | 除去苯中混有的苯酚 | 向混合液中加入过量浓溴水,充分反应后,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑥③①②④⑤ | B. | ⑤④③①②⑥ | C. | ⑥③②④①⑤ | D. | ②③①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
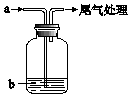 将气体a通入溶液b中,始终无明显变化的是( )
将气体a通入溶液b中,始终无明显变化的是( )| 气体a | 溶液b | |
| A | Cl2 | NaBr |
| B | CO2 | CaCl2 |
| C | SO2 | Ba(NO3)2 |
| D | NO2 | FeSO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期ⅡA族 | B. | 第二周期ⅢA族 | C. | 第二周期ⅠA族 | D. | 第二周期ⅣA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com