
【题目】如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①②③三种不同的环境中

请回答:
(1)金属腐蚀主要分为__________腐蚀和_____________腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是_________________(填序号)。
(3)①中正极的电极反应式为_________________________________________________,②中负极的电极反应式为_________________________________________。
(4)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有__________(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬
③将钢管用导线与铜条连接 ④将钢管用导线与碳棒连接
【答案】 化学 电化学 ①>③>② 2H2O + O2 + 4e- = 4OH- Zn - 2e- = Zn2+ ①②
【解析】试题分析:(1)金属腐蚀主要分为电化学腐蚀和化学腐蚀两种;(2)①构成原电池,铁是负极;②构成原电池,铁是正极;③是化学腐蚀;(3)①构成原电池,铁是负极碳是正极,正极是氧气得电子生成氢氧根离子,②构成原电池,铁是正极、锌是负极,负极锌失电子生成锌离子;(4)根据金属防护方法分析。
解析:(1)金属腐蚀主要分为电化学腐蚀和化学腐蚀两种;(2)①构成原电池,铁是负极;②构成原电池,铁是正极;③是化学腐蚀;所以铁被腐蚀的速率由快到慢的顺序是①>③>②;(3)①构成原电池,铁是负极碳是正极,正极是氧气得电子生成氢氧根离子,正极反应式为2H2O + O2 + 4e- = 4OH-;②构成原电池,铁是正极、锌是负极,负极锌失电子生成锌离子,电极反应式为Zn - 2e- = Zn2+;(4)①健身器材刷油漆,隔绝空气,金属被腐蚀的速率减慢,故①正确; ②自行车钢圈镀铬,隔绝空气,金属被腐蚀的速率减慢,故②正确;③将钢管用导线与铜条连接,构成原电池,铁是负极,腐蚀的速率加快,故③错误; ④将钢管用导线与碳棒连接,构成原电池,铁是负极,腐蚀的速率加快,故④错误。


科目:高中化学 来源: 题型:
【题目】把18.0mol/L的浓硫酸稀释成1.2mol/L的稀硫酸250mL。
(1)1.2mol/L的稀硫酸的含义是__________(选填字母)。
A.1L水中含有1.2mol H2SO4
B.1L溶液中含有1.2mol H+
C.将117.6g硫酸溶于1L水所配成的溶液
D.从100mL该溶液中取出10mL,剩余溶液的物质的量浓度仍为1.2mol/L
(2)请在下列操作步骤中填写有关的空格:
①用量筒量取_________mL的18.0mol/L的浓硫酸;
②将_______________沿烧杯内壁慢慢注入盛有少量____________的烧杯中;
③将已冷却至室温的硫酸溶液沿玻璃棒注入_________mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线1~2cm处;
⑥改用___________________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(3)由于操作不当,会引起实验误差。下列情况对所配制的H2SO4溶液的物质的量浓度有何影响?(用“偏高”、“偏低”、“无影响”填空)。
①容量瓶用蒸馏水洗涤后残留有少量的水_____________;
②定容时,某同学观察液面的情况如图所示_____________;

③摇匀后,发现溶液的液面低于刻度线,又加水至刻度线____________。
(4)某同学取配制的1.2mol/L的稀硫酸100mL,向其中加入足量的锌粒,产生的H2在标准状况下的体积为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
(2)Na3AsO4 中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图所示,则在该化合物中As的杂化方式是_________。
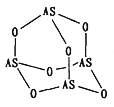
(3)自然固氮现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3-解释了民谚“雷雨发庄稼”的原理。
①NO3-中N原子采取_____杂化方式,其空间构型为________,写出它的一种等电子体的化学式________.
②已知酸性: HNO3>HNO2,下列相关见解合理的是_________.
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+,酸性强于HNO2
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NA mol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为______g·cm-3(用含NA、a的式子表示)。
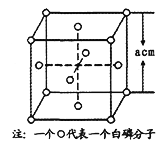
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷与Cl2的取代反应所得四种有机产物的说法不正确的是( )
A.都是有机物B.都不溶于水
C.有一种气态物质,其余均是液体D.均是正四面体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2==2H2O,下列有关说法正确的是()

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-=4OH-
C. 每转移0.1 mol电子,便消耗1.12 升的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气, 放出256.64kJ的热量。
(1)写出该反应的热化学方程式
(2)已知H2O (l) = H2O(g) △H= + 44 kJ·mol-1,则16g液态肼燃烧生成氮气和液态水时,放出的量是 kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的 优点
(4)已知N2(g)+2O2(g)=2 NO2(g) △H= +68 kJ·mol-1, N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若500℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为____。
(2)上述反应中的a_______0(填“大于”“小于”或“等于”)。
(3)700℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有____(填序号)。
A.缩小反应器体积 B.通入CO2 C.温度升高到900℃ D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素是一种用途广泛的香料,可用于配制香精以及制造日用化妆品和香皂等。以有机物M和有机物A合成香豆素的流程如下:

已知以下信息:
①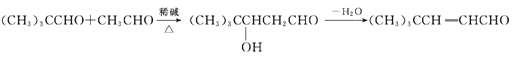
② M的分子式为C2H6O,分子中有3种化学环境不同的氢原子
③ 香豆素中含有两个六元环
(l) M的化学名称是______,由M生成B的化学方程式为_______。
(2) A的结构简式为________。
(3) D转变为E的第①步所需的试剂及反应条件是________。
(4)由E生成香豆素的化学方程式为________。
(5)写出满足如下条件的C的一种同分异构体的结构简式:________。
① 能发生银镜反应 ② 1mol C完全反应能消耗2 mol NaOH
③ 苯环上有3个取代基 ④ 苯环上的一氯代物只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下取0.1mol/L的NaA和NaB 两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O![]() HA+NaHCO3、2NaB+CO2+H2O
HA+NaHCO3、2NaB+CO2+H2O![]() 2HB+N2CO3。HA和HB 的1L 溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是
2HB+N2CO3。HA和HB 的1L 溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是
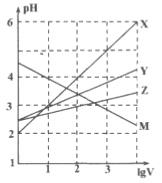
A. X是HA,M是HB
B. 常温下pH: NaA 溶液>NaB 溶液
C. 对于c(R-)/c(HR)·c(OH-)的值(R代表A或B),一定存在HA>HB
D. 若常温下浓度均为0.1mol/L 的NaA和HA 的混合溶液的pH>7,则c(A-)>c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com