
【题目】钼(Mo)是一种重要的过渡金属元素,钼酸钠(Na2MoO4)是一种无公害型冷却水系统的金属缓蚀剂。以钼精矿(主要成分为MoS2)为原料制备金属钼和钼酸钠晶体的主要流程如图所示。
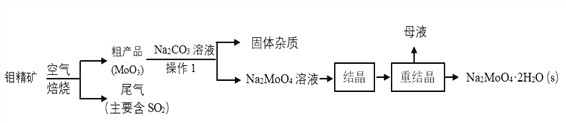
(1)Na2MoO4·2H2O 中钼元素的化合价为____________;
(2)在焙烧反应中,每生成1mol MoO3时转移电子数为:_______ (以NA表示阿伏加德罗常数的值);
(3)操作1中,粗产品中的MoO3与Na2CO3溶液充分反应后,生成Na2MoO4和另外一种物质,该物质的电子式为_____;
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因______________________________________;
(5)结晶操作前需加入Ba(OH)2固体以除去溶液中的SO42-,SO42-的最大去除率是_____(结果保留一位小数)[已知:碱浸液中c(MoO42-)=0.80mol·L-1,(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.0×10-10,Ksp(BaMoO4)=4.0×10-8,Ba(OH)2引起的溶液体积变化忽略。]
(6)下图是碳钢在3 种不同介质中的腐蚀速率实验结果:
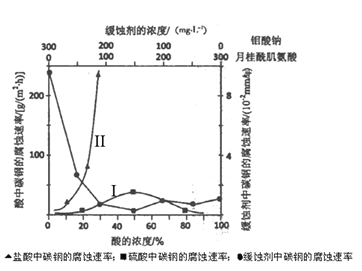
①试分析I、II曲线变化趋势不同的原因________________________________________
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3 保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_________________________________________________。
③要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_____________。
【答案】 +6 14NA ![]() 使用一定次数后,母液中杂质的浓度增大,重结晶会析出杂质,影响产品纯度 95.0% Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢 替代空气中氧气起氧化剂作用 1:1
使用一定次数后,母液中杂质的浓度增大,重结晶会析出杂质,影响产品纯度 95.0% Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢 替代空气中氧气起氧化剂作用 1:1
【解析】分析:本题以钼精矿为原料制备金属钼和钼酸钠晶体的流程为载体,考查流程的分析、氧化还原反应中转移电子数的计算、电子式的书写、与溶度积有关的计算、与碳钢腐蚀有关的图像分析。(1)根据化合物中元素的正负化合价代数和为0判断Mo的化合价。(2)根据流程写出方程式,用化合价升降法分析反应中转移电子数。(3)MoO3与Na2CO3生成Na2MoO4和CO2。(4)重结晶得到的母液使用一定次数后,母液中杂质的浓度增大,重结晶会析出杂质,影响产品纯度。(5)要求SO42-的最大去除率,计算MoO42-开始沉淀时溶液中c(Ba2+),进一步计算此时溶液中c(SO42-),从而确定SO42-的最大去除率。(6)①碳钢在盐酸、硫酸中腐蚀速率不同是由于阴离子的不同引起的;钢铁在浓硫酸中发生钝化。②分析题给信息,NaNO2替代空气中O2。③根据图像判断。
详解:(1)Na2MoO4·2H2O中Na元素的化合价为+1价,H元素的化合价为+1价,O元素的化合价为-2价,根据化合物中元素的正负化合价代数和为0,Mo元素的化合价为+6价。
(2)根据流程,焙烧时反应的化学方程式为2MoS2+7O2![]() 2MoO3+4SO2,在该反应中O元素的化合价全部由0价降至-2价,生成2molMoO3反应中转移28mol电子,则每生成1molMoO3转移14mol电子,转移电子数为14NA。
2MoO3+4SO2,在该反应中O元素的化合价全部由0价降至-2价,生成2molMoO3反应中转移28mol电子,则每生成1molMoO3转移14mol电子,转移电子数为14NA。
(3)操作1中,MoO3与Na2CO3溶液充分反应生成Na2MoO4和CO2,CO2的电子式为![]() 。
。
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是:重结晶得到的母液使用一定次数后,母液中杂质的浓度增大,重结晶会析出杂质,影响产品纯度。
(5)SO42-达到最大去除率,要求MoO42-开始沉淀时的c(Ba2+)。MoO42-开始沉淀时溶液中c(Ba2+)=Ksp(BaMoO4)/c(MoO42-)=4![]() 10-8
10-8![]() 0.8=5
0.8=5![]() 10-8(mol/L),此时溶液中c(SO42-)=Ksp(BaSO4)/c(Ba2+)=1.0
10-8(mol/L),此时溶液中c(SO42-)=Ksp(BaSO4)/c(Ba2+)=1.0![]() 10-10
10-10![]() (5
(5![]() 10-8)=0.002(mol/L),SO42-的最大去除率为
10-8)=0.002(mol/L),SO42-的最大去除率为![]() 100%=95.0%。
100%=95.0%。
(6)①分析图像,I、II曲线变化的趋势是:随着盐酸浓度的增大,碳钢的腐蚀速率明显加快;随着硫酸浓度的增大,碳钢的腐蚀速率先加快后减慢;碳钢在盐酸中腐蚀速率比在硫酸中快。产生不同变化趋势的原因是:Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得碳钢在盐酸中的腐蚀速率明显快于硫酸;硫酸溶液随着浓度的增大,氧比性增强,会使碳钢钝化,腐蚀速率减慢。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜,密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2,NaNO2相当于空气,NaNO2的作用是:替代空气中氧气起氧化剂作用。
③根据图像,当钼酸钠和月桂酰肌氨酸都为150mg/L时,碳钢的腐蚀速率最慢,即要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比为1:1。


科目:高中化学 来源: 题型:
【题目】已知A原子中只含1个电子;B原子的3p轨道上得到1个电子后不容纳外来电子;C原子的2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四电子层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)按要求书写下列图式。
①B原子的结构示意图:________;
②C原子的电子排布图:________;
③D原子的核外电子排布式:________;
④B离子的电子式:________。
(2)写出由A、B、C、D中的三种元素组成的化合物的化学式:___________(至少写出5种)。
(3)写出由上述元素组成的物质制得A的单质的化学方程式:___________(至少写出2个)。
(4)写出E的元素符号:________,要证明太阳光中含有E元素,可采用的方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空
(1)决定物质体积的因素:①构成物质的粒子数;②粒子大小;③粒子间的距离。对固体、液体物质而言,它主要是由上述________(填写编号,下同)决定;对气体物质而言,它主要由上述____________决定。
(2)标准状况下,体积为11.2 L的CO2的质量________g,其所含原子的总数是________个。
(3)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
①该气体的物质的量为________mol。
②该气体在标准状况下的体积为________ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素及其化合物的应用研究是目前科学研究的前沿之一。请回答下列问题:
二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁熔点是173℃(在100℃时开始升华),沸点是249℃。
(1)基态Fe2+离子的价电子排布式为_______________________________
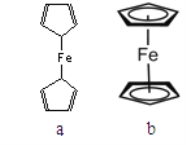
(2)二茂铁属于___________________晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为下图中的________________(选填“a”或“b”)
(3)环戊二烯(![]() )中C的杂化方式 _______________。1mol环戊二烯中含有σ键的数目为___________。
)中C的杂化方式 _______________。1mol环戊二烯中含有σ键的数目为___________。
(4)分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),在C5H5—中的每个碳原子上都有一个未参与σ键的电子,这些电子占据与环的平面垂直的p轨道上。C5H5—的大π键可以表示为______________。
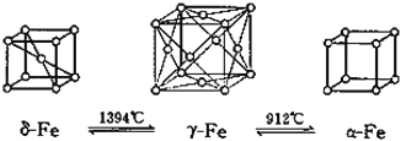
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是_______
A.γ﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.若δ﹣Fe晶胞边长为acm,α﹣Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体性质会产生重大影响。由于晶体缺陷,晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm-3,晶胞边长为4.28×10-10 m,则FexO中x=_____(用代数式表示,不要求算出具体结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,仪器使用不正确的是( )
A. 熄灭酒精灯用灯帽盖灭
B. 加热烧杯时垫石棉网
C. 在量筒中稀释浓硫酸
D. 制取乙烯时,温度计插入混合液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除![]() 外,还有( )
外,还有( )
A. 7种 B. 11种 C. 14种 D. 17种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com