
����Ŀ���л���I����Ҫ�л��м��壬��ϳ�·�ߣ����ַ�Ӧ��������ȥ������ͼ��ʾ��

��֪��
R �� CN![]() R �� COOH
R �� COOH
�ش��������⣺
��1��A�Ľṹ��ʽ��______________��
��2��B�к��еĹ�������______________��
��3��D��һ�ֺϳɸ߷��ӣ����Ľṹ��ʽ��______________��
��4��I�������۷�Ӧ�Ļ�ѧ����ʽ��______________��
��5��G��H�ķ�Ӧ������______________��
��6��E��F��Ӧ�Ļ�ѧ����ʽ��______________��
��7������˵����ȷ����________��
������I�ܷ�����ȥ��Ӧ
��F��G���̲����ĸ����� ����G��Ϊͬ���칹��
����G��Ϊͬ���칹��
��B��D������˳���칹
��8����������Ϣ������ϩ��HBrΪ��ʼԭ���Ʊ����ᣬ��ƺϳ�·�ߣ������Լ���ѡ��________�����ϳ�·�߳��õı�ʾ��ʽΪ��![]()
���𰸡� CH3��CH == CH2 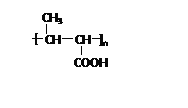 ̼̼˫�������� n
̼̼˫�������� n +(n-1)H2O ȡ����Ӧ CH2=CHCH2��Cl +NaOH
+(n-1)H2O ȡ����Ӧ CH2=CHCH2��Cl +NaOH ![]() CH2=CHCH2��OH+NaCl �٢� CH2=CH2
CH2=CHCH2��OH+NaCl �٢� CH2=CH2 ![]() CH3��CH2��Br
CH3��CH2��Br![]() CH3��CH2��CN
CH3��CH2��CN![]() CH3CH2COOH
CH3CH2COOH
����������ͼ����Ϣ��֪��Bͨ���Ӿ۷�Ӧ����C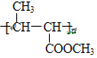 ����BΪC�ĵ��壬B�Ľṹ��ʽΪCH3CH=CHCOOCH3��A����ʽΪC3H6����״���CO����Ӧ����B�����ݽṹ��ʽ��֪AΪCH3CH=CH2��
����BΪC�ĵ��壬B�Ľṹ��ʽΪCH3CH=CHCOOCH3��A����ʽΪC3H6����״���CO����Ӧ����B�����ݽṹ��ʽ��֪AΪCH3CH=CH2��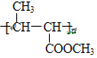 �ڼ��������·���ˮ�ⷴӦ���ữ�õ�D����DΪ
�ڼ��������·���ˮ�ⷴӦ���ữ�õ�D����DΪ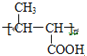 ��A��������Ӧ����E��E����������ˮ��Һ�м���ˮ������FΪ������EӦ��Ϊһ�ȴ��BΪCH2=CHCH2Cl��FΪCH2=CHCH2OH��������֪R �� CN
��A��������Ӧ����E��E����������ˮ��Һ�м���ˮ������FΪ������EӦ��Ϊһ�ȴ��BΪCH2=CHCH2Cl��FΪCH2=CHCH2OH��������֪R �� CN![]() R �� COOH��
R �� COOH��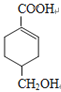 ��H��Ӧ���ã���HΪ
��H��Ӧ���ã���HΪ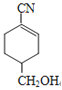 ��G��NaCN��Ӧ����H����GΪ
��G��NaCN��Ӧ����H����GΪ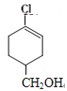 ��������֪
��������֪ ��CH2=CHCH2OH��
��CH2=CHCH2OH��![]() ��Ӧ����GΪ
��Ӧ����GΪ ����1��A�Ľṹ��ʽ��CH3CH=CH2����2��BΪCH3CH=CHCOOCH3�����еĹ�������̼̼˫������������3��D��һ�ֺϳɸ߷��ӣ����Ľṹ��ʽ��
����1��A�Ľṹ��ʽ��CH3CH=CH2����2��BΪCH3CH=CHCOOCH3�����еĹ�������̼̼˫������������3��D��һ�ֺϳɸ߷��ӣ����Ľṹ��ʽ��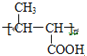 ����4��I��
����4��I�� ���������۷�Ӧ�Ļ�ѧ����ʽ��n
���������۷�Ӧ�Ļ�ѧ����ʽ��n +(n-1)H2O����5��G��H��
+(n-1)H2O����5��G��H�� ��NaCN��Ӧ����
��NaCN��Ӧ���� ����Ӧ������ȡ����Ӧ����6��E��F��Ӧ�Ļ�ѧ����ʽ��CH2=CHCH2Cl +NaOH
����Ӧ������ȡ����Ӧ����6��E��F��Ӧ�Ļ�ѧ����ʽ��CH2=CHCH2Cl +NaOH ![]() CH2=CHCH2OH+NaCl����7��������I��
CH2=CHCH2OH+NaCl����7��������I�� ���д��ǻ�������̼���ڵ�̼������ԭ�ӣ��ܷ�����ȥ��Ӧ������ȷ����F��G���̲����ĸ�����
���д��ǻ�������̼���ڵ�̼������ԭ�ӣ��ܷ�����ȥ��Ӧ������ȷ����F��G���̲����ĸ�����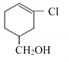 ��������Gֻ��̼̼˫����λ�ò���ͬ����Ϊͬ���칹�壬����ȷ����CH3CH=CHCOOCH3����˳���칹��
��������Gֻ��̼̼˫����λ�ò���ͬ����Ϊͬ���칹�壬����ȷ����CH3CH=CHCOOCH3����˳���칹��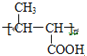 ������˳���칹���ʴ���ѡ�٢ڣ���8����ϩ��HBr�ڴ��������·����ӳɷ�Ӧ����CH3��CH2��Br��CH3��CH2��Br��NaCN��Ӧ����CH3��CH2��CN��CH3��CH2��CN���������������·�Ӧ���ữ�õ����ᣬ�ϳ�·�����£�CH2=CH2
������˳���칹���ʴ���ѡ�٢ڣ���8����ϩ��HBr�ڴ��������·����ӳɷ�Ӧ����CH3��CH2��Br��CH3��CH2��Br��NaCN��Ӧ����CH3��CH2��CN��CH3��CH2��CN���������������·�Ӧ���ữ�õ����ᣬ�ϳ�·�����£�CH2=CH2 ![]() CH3��CH2��Br
CH3��CH2��Br![]() CH3��CH2��CN
CH3��CH2��CN![]() CH3CH2COOH��
CH3CH2COOH��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����A�����ֽ⣬ʵ�����̺ͽ�����£�

B��CΪ��������������Ԫ����ͬ������C�ڱ�״�����ܶ�Ϊ1.96g��L-1����ش�
��1����ɫ�����Ļ�ѧʽ___________________��
��2��д��A���ȷֽ�Ļ�ѧ����ʽ___________________��
��3��ȡ��������D����ϡ���ᣬ����������KI��Һ����Ӧ����Һ���ػ�ɫ��ͬʱ����һ�ְ�ɫ�ĵ⻯�������д����������������ӷ���ʽ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ά����C��������Ѫ�ᣬ�ṹ��ʽΪ ��ά����C�ڼ�����Һ���ױ��������ܱ�I2��������
��ά����C�ڼ�����Һ���ױ��������ܱ�I2�������� �ⶨ������ά����C�ĺ�����ʵ�鲽�����£���������ˮ���������ȴ����
�ⶨ������ά����C�ĺ�����ʵ�鲽�����£���������ˮ���������ȴ����
����һ����1.3 g I2��������KIŨ��Һ��ת��1000 mL����ƿ�У���������ˮ���ݺ�������ɫƿ�ܹⱣ�棬���á�
���������ȡ100 gȥƤ��ȥ�˵����ʳ��Ӻ�40 mL������Һ���ե֭����֭ȫ��������ƿ�����������Ļ���̿�����ˣ������ù�֭ϡ����100 mL�ܷⱣ�档
��������ȷ��ȡ10.00 mL��֭������20 mL l%������Һ��1mL l%������Һ���ñ�����Һ���еζ����յ㣬��¼���ĵı�����Һ�������
�����ģ��ظ�������2~3�Ρ�
�����壺���ݴ���������100g������ά����C�ĺ�����
(1)����һ�����Ʊ�����Һʱ����I2���뵽KIŨ��Һ��Ŀ����____________������Ҫ�IJ����������ձ���1000 mL����ƿ��_____��
(2)������м������̿��������____������ʹ�õ���Ҫ������____��
(3)�ڲ�����Ͳ������о����������Һ��Ŀ����___________��
(4)������Ͳ�����ͨ���������2��������ɣ�����ʱ�ᵼ�²ⶨ��� ________�ƫ����ƫС������Ӱ�족����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����Ҫ�л��ϳ��м��壬ʵ���ҿ������·�Ӧ�Ʊ���C6H6 + HNO3 ![]() C6H5��NO2 + H2O ��H < 0����֪�÷�Ӧ���¶��Ըߵ�����»����ɼ�����������й��������±���
C6H5��NO2 + H2O ��H < 0����֪�÷�Ӧ���¶��Ըߵ�����»����ɼ�����������й��������±���
���� | �� | ������ | ��������� | Ũ���� | Ũ���� |
�е�/�� | 80 | 211 | 301 | 83 | 338 |
�ܽ��� | ����ˮ | ������ˮ | ����ˮ | ������ˮ | ������ˮ |
����˵������ȷ����
A. �Ʊ��������ķ�Ӧ����Ϊȡ����Ӧ
B. ��������ķ����ɽ��������ӷ�Ӧ���ò��������ȷ������
C. �÷�Ӧ�¶ȿ�����50-60���ԭ���Ǽ��ٷ�Ӧ��Ļӷ������������
D. ���ü���NaOH��Һ��ˮϴ�ӡ��Լ���Һ�ķ����ɳ�ȥ���������л��е�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ܱ������н��з�ӦmX(g)��nY(g) ![]() qZ(g)��H>0��m��n<q�ﵽƽ��ʱ������˵����ȷ���� �� ��
qZ(g)��H>0��m��n<q�ﵽƽ��ʱ������˵����ȷ���� �� ��
A. ͨ��ϡ������ʹѹǿ����ƽ�⽫�����ƶ�
B. X���淴Ӧ������Y������Ӧ���ʵ�n/m��
C. �����¶ȣ���������ƽ����Է���������С
D. ����X�����ʵ�����X��ת���ʽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�ɷ�ΪFeTiO3����������MgO��SiO2�����ʣ���Li4Ti5O12��LiFePO4��������ӵ�صĵ缫���ϣ����������������Ʊ��������������£�

��1����������Ԥ����ʱ��Ҫ���з��飬��ԭ����___________________��
��2�����̢��з�Ӧ�����ӷ���ʽ�ǣ� FeTiO3 + 4H++ 4Cl��== Fe2+ + TiOCl42��+ 2H2O��_______��
��3�����̢��У����Ľ����ʽ����ͼ1��ʾ����ͼ��֪�������Ľ�����Ϊ80%ʱ�������õ�ʵ��������___________________��

��4�����̢��й���TiO2��˫��ˮ����ˮ��Ӧת����(NH4)2Ti5O15��Һʱ��TiԪ�صĽ������뷴Ӧ�¶ȵĹ�ϵ��ͼ2��ʾ����Ӧ�¶ȹ���ʱ��TiԪ�ؽ������½���ԭ����___________��
��5������ҺBת��ΪFePO4���������з������·�Ӧ������ƽ��
Fe2+ +_____ + H3PO4 ===FePO4 + ____ + _____
��6�����̢�����FePO4�Ʊ�LiFePO4�Ļ�ѧ����ʽ��_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�ݻ�һ�����ܱ������У������п��淴Ӧ��A��g��+B��g��xC��g������ͼ����ʾ�ķ�Ӧ���ߣ����ж϶�ͼ���˵������ȷ���ǣ�T��ʾ�¶ȣ�P��ʾѹǿ��C%��ʾC������������������� 
A.P3��P4 �� y���ʾB���������
B.P3��P4 �� y���ʾ���������ܶ�
C.P3��P4 �� y���ʾB�İٷֺ���
D.P3��P4 �� y���ʾ��������ƽ��Ħ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¡��ݻ�Ϊ1L���������£�����Է�������ת�����䷴Ӧ���̺�������ϵ��ͼ��ʾ[��֪��2SO2��g��+O2��g��2SO3��g����H=��196.6kJ/mol]�� 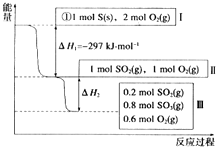
��ش��������⣺
��д���ܱ�ʾ���ȼ���ȵ��Ȼ�ѧ����ʽ�� ��
�ڡ�H2= kJ/mol��
������ͬ�����£�����1mol SO3��0.5mol O2 �� ��ﵽƽ��ʱSO3��ת����Ϊ����ʱ�÷�Ӧ����ų��������ա��� kJ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л���ķ���ʽ��ΪC8H8�������ʽ�ֱ��ʾΪX��![]() ��Y��
��Y��![]() ��Z��
��Z��![]() ������˵����ȷ����
������˵����ȷ����
A. X��Z����������ԭ��һ����ͬһƽ����
B. X��Y��Z���ܷ���ȡ����Ӧ���ӳɷ�Ӧ��������Ӧ
C. X��Y��Z��Ϊͬ���칹�壬���Ƕ��ȴ����ͬ���칹����Ŀ����ͬ
D. X��Y��Z����ʹ���Ը��������Һ��ɫ��Ҳ��ʹ������Ȼ�̼��Һ��ɫ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com