
ij�¶��£���һ�̶��ݻ����ܱ�������Ͷ��һ�����ʵ�����N2��H2���п��淴Ӧ��N2(g)��3H2(g)  2NH3(g) ��2 minʱ�ﵽƽ��״̬����ʱc(N2)��5.00 mol/L��c(H2)��10.00mol/L��c(NH3)��5.00 mol/L������д��������̣�
2NH3(g) ��2 minʱ�ﵽƽ��״̬����ʱc(N2)��5.00 mol/L��c(H2)��10.00mol/L��c(NH3)��5.00 mol/L������д��������̣�
��1�����¶��£���Ӧ��ƽ�ⳣ���Ƕ��٣�
��2��H2����ʼŨ�ȣ�
��3����N2��ʾ�÷�Ӧ�ķ�Ӧ�����Ƕ��٣�
��4��N2��ת���ʣ�������λ��Ч���֣���

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
(14��)��ҵ������·ѭ����������������Ĺ�����������ͼ��ʾ��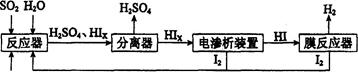
�ش��������⣺
��1���ڷ�Ӧ���з�����Ӧ�Ļ�ѧ����ʽ��______________��
��2����Ĥ��Ӧ���з�����Ӧ��2HI(g) H2(g)ʮI2 ��H>0������һ���������ܱ������м���l mol HI(g)�� n(H2)��ʱ��(t)�ı仯��ͼ��ʾ��
H2(g)ʮI2 ��H>0������һ���������ܱ������м���l mol HI(g)�� n(H2)��ʱ��(t)�ı仯��ͼ��ʾ��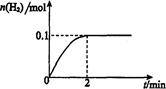
�ٸ��¶��£���Ӧƽ�ⳣ��K=_______���������¶ȣ�Kֵ��_______
(���������������?��)��
���û�ѧƽ��ԭ������ʹ��Ĥ��Ӧ����ʱ�����H2��Ŀ����___________________
��3��������װ������ͼ��ʾ��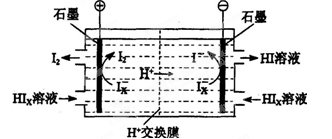
�ٽ�ϵ缫��Ӧʽ����������HIxת��ΪHI��ԭ����______________________________
�ڸ�װ���з������ܷ�Ӧ�Ļ�ѧ����ʽ��________________________
��4����������������ѭ�����õ�������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��Ļ������������Ϳ����з�������Ҫ���á�
��1��SO2Cl2����������ҽҩƷ��Ⱦ�ϡ�������Լ��ȡ���֪��SO2Cl2(g) SO2(g)��Cl2(g) ��H����97.3 kJ��mol��1��ij�¶�ʱ�����Ϊ1 L�ĺ����ܱ������г���0. 20mol SO2Cl2���ﵽƽ��ʱ�������к�0.18mol SO2����˹��̷�Ӧ���յ�����Ϊ_____ kJ�����¶�ʱ��Ӧ��ƽ�ⳣ��Ϊ_____�����������û��������������BaCl2��Һ�У��������ɳ���������Ϊ_______��
SO2(g)��Cl2(g) ��H����97.3 kJ��mol��1��ij�¶�ʱ�����Ϊ1 L�ĺ����ܱ������г���0. 20mol SO2Cl2���ﵽƽ��ʱ�������к�0.18mol SO2����˹��̷�Ӧ���յ�����Ϊ_____ kJ�����¶�ʱ��Ӧ��ƽ�ⳣ��Ϊ_____�����������û��������������BaCl2��Һ�У��������ɳ���������Ϊ_______��
��2����ҵ���Ʊ�����Ĺ����д��ڷ�Ӧ��2SO2(g)��O2(g) 2SO3(g) ��H����198kJ��mol��1��400�棬1.01��105Pa�����ݻ�Ϊ2L�ĺ����ܱ������г���һ���� SO2��O2��n(SO3)��n(O2)��ʱ��ı仯������ͼ��ʾ��
2SO3(g) ��H����198kJ��mol��1��400�棬1.01��105Pa�����ݻ�Ϊ2L�ĺ����ܱ������г���һ���� SO2��O2��n(SO3)��n(O2)��ʱ��ı仯������ͼ��ʾ��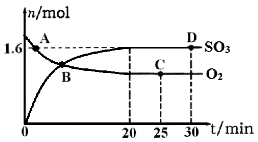
��0��20min��Ӧ��ƽ�����ʦ�(O2)��___________��
������������ȷ���� ��
a��A�����(SO2)������(SO2)
b��B�㴦��ƽ��״̬
c��C���D��n(SO2)��ͬ
d�������������䣬500��ʱ��Ӧ��ƽ�⣬n(SO3)��ͼ��D���ֵ��
��3����ҵ����Na2SO3��Һ���������е�SO2��������ͨ��1.0 mol��L��1��Na2SO3��Һ������ҺpHԼΪ6ʱ��Na2SO3��Һ����SO2�����������½���Ӧ�������ռ�����ʱ��Һ��c (SO32��)��Ũ����0.2 mol��L��1������Һ��c(HSO3��)��__mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
����ʯ����ѧʽ��ʾΪMgCO3��CaCO3��Ϊԭ���Ʊ�Mg(OH)2�Ĺ�����������ͼ��ʾ��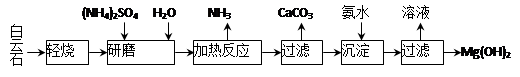
��1����ĥ�������� ��
��2���ù����п�ѭ��ʹ�õ������� �� ��д��ѧʽ����
��3������ʯ���յ���Ҫ������MgO��CaCO3������ͳ�����ǽ�����ʯ���ȷֽ�ΪMgO��CaO����ȡ������ʯ���յ��ŵ��� ��
��4�����ȷ�Ӧ�����ӷ���ʽΪ ��
��5���ټ��ȷ�Ӧʱ����323k��353k��Һ��c(NH4+)�뷴Ӧʱ��Ĺ�ϵ����ͼ��ʾ��������ͼ����373k�����ߡ�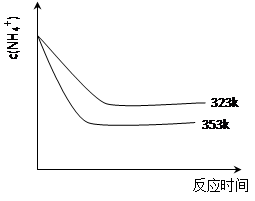
����ͼ��֪�������¶����ߣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
̼���������ĵ��ʼ��仯�����ڹ�ũҵ����������������Ҫ�����á�
��1�����̼�Ȼ�ԭ���Ȼ�����ʵ���������Ʊ�������������ص��Ȼ�ѧ����ʽ���£�
2Al2O3(s)��2AlCl3(g)��6C(s)=6AlCl(g)��6CO(g) ��H��a kJ��mol��1
3AlCl(g) ��2Al(l)��AlCl3(g) ��H��b kJ��mol��1
��ӦAl2O3(s)��3C(s)��2Al(l)��3CO(g)�ġ�H�� kJ��mol��1(�ú�a��b�Ĵ���ʽ��ʾ)��
��2���û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO��������ӦC(s)+2NO(g) N2(g)+CO2(g) ��H="Q" kJ��mol��1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g)+CO2(g) ��H="Q" kJ��mol��1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
| ʱ�䣨min�� Ũ�ȣ�mol/L�� | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��������β���Ǽ��ٳ��п�����Ⱦ���ȵ��о����⡣
��1��������ȼ������ʱ�����ķ�ӦN2(g) + O2(g) 2NO(g)�����ɵ�NO������β������Ҫ��Ⱦ�T ��ʱ����5L�ܱ������г���6.5 molN2��7.5 molO2����5 minʱ��Ӧ�ﵽƽ��״̬����ʱ������NO�����ʵ�����5 mol�������Ǻ�����Ӧ������
2NO(g)�����ɵ�NO������β������Ҫ��Ⱦ�T ��ʱ����5L�ܱ������г���6.5 molN2��7.5 molO2����5 minʱ��Ӧ�ﵽƽ��״̬����ʱ������NO�����ʵ�����5 mol�������Ǻ�����Ӧ������
��5 min�ڸ÷�Ӧ��ƽ�����ʦ�(NO) = ����T ��ʱ���÷�Ӧ��ƽ�ⳣ��K = ��
�� ��Ӧ��ʼ���ﵽƽ��Ĺ����У����������и�����仯���� ������ţ���
a�����������ܶ� b����������ѹǿ
c������Ӧ���� d����λʱ���ڣ�N2��NO��������֮��
��2����H2��CO����ԭNO���Դﵽ������Ⱦ��Ŀ�ġ�
��֪��2NO(g) = N2(g) + O2(g) ? ��H =" ��180.5" kJ��mol��1
2H2O(l) =2H2(g) + O2(g) ?��H =" +571.6" kJ��mol��1
��H2(g)��NO(g)��Ӧ����N2(g)��H2O(l)���Ȼ�ѧ����ʽ��
��
��3��������һ��ʱ�������������ı���������ѧ��Ӧ���ʡ���ͼ��ʾ��������������ʱ����Ӧ2NO(g) + 2CO(g)
 2CO2(g) + N2(g) �У�NO��Ũ��[c(NO)]���¶ȣ�T���������������S����ʱ�䣨t���ı仯���ߡ�
2CO2(g) + N2(g) �У�NO��Ũ��[c(NO)]���¶ȣ�T���������������S����ʱ�䣨t���ı仯���ߡ�
�� �÷�Ӧ��?H 0 ���������������
���������ı����S1��S2 ������ͼ�л���c(NO) ��T1�� S2 �����´ﵽƽ������еı仯���ߣ�������Ӧ��ע����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�̶�������CO2������Ч��������Դ�������ٿ����е��������塣��ҵ�������о�����CO2�������״�ȼ�ϵķ������÷����Ļ�ѧ����ʽ�ǣ�
CO2��g����3H2��g�� CH3OH��g����H2O��g��
CH3OH��g����H2O��g��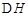 =-49��0kJ��mol
=-49��0kJ��mol
ij��ѧʵ��С�齫6mol CO2��8mol H2����һ�ݻ�Ϊ2L���ܱ������У��¶ȱ��ֲ��䣩�����H2�����ʵ�����ʱ��仯����ͼ��ʵ����ʾ��ͼ����ĸ������ֱ�ʾ��Ӧ�����꣩���ش��������⣺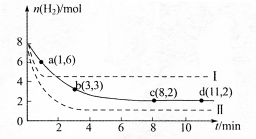
��1���÷�Ӧ��0~8min��CO2��ƽ����Ӧ������ mol��L-1��min-1
��2�����¶��¸÷�Ӧ��ƽ�ⳣ��K����ֵΪ ��
��3�����ı�ijһ�����ٽ���ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ��
��ʵ����ȣ����ߢ�ı������������ �����ߢ�ı������������ ����ʵ�߶�Ӧ������ƽ�ⳣ��Ϊ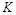 �����ߢ��Ӧ������ƽ�ⳣ��Ϊ
�����ߢ��Ӧ������ƽ�ⳣ��Ϊ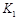 �����ߢ��Ӧ������ƽ�ⳣ��Ϊ
�����ߢ��Ӧ������ƽ�ⳣ��Ϊ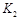 ����
����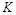 ��
��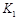 ��
��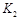 �Ĵ�С��ϵ�� ��
�Ĵ�С��ϵ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��16�֣�Na2S2O8��Һ�ɽ����л���Ⱦ��4-CP��ԭ����Na2S2O8��Һ��һ�������¿ɲ���ǿ���������ɻ���SO4-����ͨ���ⶨ4-CP�����ʿ��ж�Na2S2O8��Һ������SO4-����������ij�о�С��̽����Һ����ԡ�Fe2+��Ũ�ȶԲ�����SO4-������Ӱ�졣
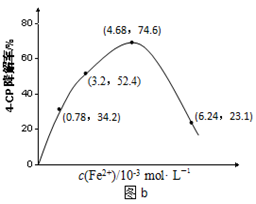
��1����Һ����Ե�Ӱ�죺����������ͬ����4-CP���뵽��ͬpH��Na2S2O8��Һ�У������ͼa��ʾ���ɴ˿�֪����Һ������ǿ�� ���� �������ڡ������ڡ���Na2S2O8����SO4-����
��2��Fe2+Ũ�ȵ�Ӱ�죺��ͬ�����£�����ͬŨ�ȵ�FeSO4��Һ�ֱ����c(4-CP)=1.56��10-4 mol��L��1��c(Na2S2O8)=3.12��10-3 mol��L��1�Ļ����Һ�С���Ӧ240 min����ʵ������ͼb��ʾ��
��֪ S2O82- + Fe2+= SO4-��+ SO42- + Fe3+��������ܻᷢ����SO4-�� + Fe2+��SO42- + Fe3+
�� ʵ�鿪ʼǰ������FeSO4��Һ�Ƿ��������Լ��� ����ѧʽ�����类�������Թ۲쵽�������� ��
�ڵ�c(Fe2+)��3.2 ��10-3 mol��L��1ʱ��4-CP������Ϊ %��4-CP�����ƽ����Ӧ���ʵļ������ʽΪ ��
�۵�c(Fe2+)����ʱ��4-CP�����ʷ����½���ԭ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�������ˮ�ⷴӦ����ʽΪ��HCOOCH3 + H2O  HCOOH + CH3OH �C Q��Q>0��
HCOOH + CH3OH �C Q��Q>0��
ijС��ͨ��ʵ���о��÷�Ӧ����Ӧ����������仯���Բ��ƣ�����Ӧ��ϵ�и���ֵ���ʼ�����±����������ת�������¶�T1���淴Ӧʱ�䣨t���ı仯����ͼ��
| ��� | ���ʵ���/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com