
����Ŀ�����������к��д����ķ������Ϻ��ؽ�������ҵ�Ͽ��Դӵ��ӷ���(����������ֻ��ϼ�)����ȡ�����Ľ�����ͭ��ÿ�ֵ��ӷ������ܹ���ȡ��130����ͭ��0.45����ƽ��2�����������ȡ�������£�

��ش��������⣺
(1)�����ܡ������У���ˮ���Ӧ�Ļ�ѧ����ʽΪ________________________��
(2)����ȡ�������У������Һ��������Ҫ����Ҫ����Ϊ____________________����������ʹ��ǰ������еIJ���Ϊ____________________________��
(3)����ԭ���Ʊ�����Ag�Ĺ����У�������Ӧ�ı�����Zn��AgCl�ڵ����HCl���γ���أ��ù��̵��ܷ�ӦΪ��2AgCl+Zn=2Ag+ZnCl2����õ�������ĵ缫��ӦʽΪ__________________________��
(4)��������Ҫ�ɷ�ΪCu2(OH)2CO3����ͭ�������з�����Ӧ�����ӷ���ʽΪ______________________��
(5)��ҺΪNaCl��Na2CO3��NaHCO3�Ļ��Һ���������������ʵ����ʵ���Ũ����ͬ������Һ�и�����Ũ�ȵĴ�С˳��Ϊ______________________��
(6)�����±������ݣ��ۺϷ�����ҵ�Ͻ��С���ԭ��������ѡ�õĻ�ԭ�����Ϊ______________��
���� | �۸�Ԫ����-1�� |
˫��ˮ����30%H2O2�� | 3200 |
�̷�����99.0%FeSO4��7H2O�� | 1800 |
���������ƣ���99.5%NaHSO3�� | 2850 |
���ᣨ��99.0%H2C2O4) | 3000 |
���𰸡� Au+HNO3+4HCl=HAuCl4+2H2O+NO�� ��Һ©�� ��© AgCl+e-=Ag+Cl- 2Cu2++3CO32-+2H2O=Cu2(OH)2CO3��+2HCO3- c(Na+)>c(HCO3-)>c(Cl-)>c(CO32-)>c(OH-)>c(H+) ����
�����������黯ѧ�������̣���1�������ܡ������У���ˮ��HNO3��HCl�Ļ���Auת����HAuCl4��HNO3��Nת����NO�������Au��HNO3��HCl��HAuCl4��NO����H2O��Ȼ����ݻ��ϼ�������������ƽ������ѧ��Ӧ����ʽΪAu+HNO3+4HCl=HAuCl4+2H2O+NO������2����ȡʱ�õ�����Ҫ�����Ƿ�Һ©�����ձ���ʹ�÷�Һ©��ʱ��������֤��Һ©���Ƿ�©Һ����3������ԭ��صĹ���ԭ���������ϵõ����ӣ����ϼ۽��ͣ������ܷ�Ӧ���ó�������ӦʽΪAgCl��e��=Ag��Cl������4����ͭʱ����CuCl2��Һ�ּ���������Na2CO3��Һ������Cu2(OH)2CO3�����ݣ�5������ʾ����Һ�����µ�������NaHCO3������ͭʱ����NaHCO3������ͭʱ�����ӷ���ʽΪ2Cu2��+ 3CO32��+2H2O= Cu2(OH)2CO3��+2HCO3�� ����5���������ʵ�����ͬ��c(Na��)��࣬��ΪCO32����ˮ��̶ȴ���HCO3����ˮ��̶ȣ����c(HCO3��)>c(Cl��)>c(CO3��)��CO32��ˮ�����Һ�Լ��ԣ���c(OH��)>c(H��)��ˮ��̶������������Ũ�ȴ�С˳����c(Na��)>c(HCO3��)>c(Cl��)>c(CO32��)>c(OH��)>c(H��)����6��H2O2��H2O2�����ͣ��Ҽ۸����˲�ѡH2O2���̷�����Ȼ�۸���ˣ������ݵ�ʧ������������������ʵ������̷��Ͳ�����ȣ���ԭЧ�����һ�����ٽ����Է������������Եó�������̷��ijɱ��ͣ����������ƣ��п��ܲ���SO2���Ի���������Ⱦ����˻�ԭ����õ��Dz��ᡣ


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A. ������ͬ���壬������������������������������Ҳ������������
B. �������ڼ����ӵİ뾶���������μ�С
C. �ڹ���Ԫ����Ѱ�Ҵ��������¡���ʴ�ĺϽ����
D. �õ���ʽ��ʾHCl���γɹ���![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У������õ���ֱ�ӻ����Ƶõ��ǣ� ��
A.CuCl2
B.FeCl2
C.MgCl2
D.Fe3O4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���2.4molA��1.2molB�����������Ϻ����ݻ�Ϊ2L��ij�ܱ������У��������·�ӦA��g��+B��g��x C��g��+D��g����H��0��2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������д���пհף�
��1��xֵ���� 2min��v��B��= ��
��2��A��ת����Ϊ ��
��3���÷�Ӧ�ﵽƽ��ʱ�����������м���1.2molA��0.6molB���ٴδﵽƽ���A��ת���������������С�����䡱����
��4���÷�Ӧ��ƽ�ⳣ���ı���ʽk= �� 450��ʱƽ�ⳣ��500��ʱƽ�ⳣ��������ڡ�����С�ڡ����ڡ�����
��5����ͬ�¶��£�����ʼʱ��������г���0.4mol A��0.4mol B��0.2molC��0.2molD����Ӧ�ﵽƽ��ǰ����Ӧ����v��v������������������ﵽƽ��ʱD��Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A30g��ȫȼ������44gCO2��18gˮ��
(1)��A������ͼ��Ӧ��
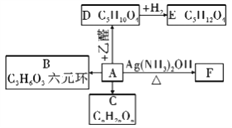
��֪��![]() CH3CH=CHCHO
CH3CH=CHCHO
��A�й����ŵ�����______________��
����д������B�Ľṹ��ʽ____________________��
��E����______________________����������C5H4O4��
(2)��A�����·�Ӧ��
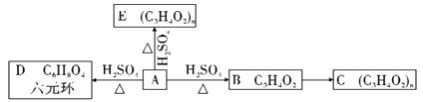
����д��A����D�Ļ�ѧ��Ӧ����ʽ_______________________________��
��A����E�ķ�Ӧ����_____________;B����C�ķ�Ӧ����__________________��
��A��һ��ͬ���칹��A1����A�������Ƶķ�Ӧ,���������ɵ�D1���ʺ��а�Ԫ������д��A1�Ľṹ��ʽ____________________��
(3)��A�������·�Ӧ��
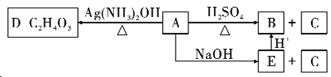
����д��A�Ľṹ��ʽ____________________��
�ڷ���ʽΪC9H18O2������M��A����ͬһ�����ʣ��ҿ�������������ˮ��Ϊ�������������ͬ�����ʣ������������B��ͬ���칹����__________�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
����Ҫ����������ʽ(���ۻƣ��ƻƵ�)��������Ȼ�硣�鼰�仯������Ҫ���ںϽ�ұ����ũҩҽҩ�����ϵȹ�ҵ��������й��鼰�仯�����ת����ϵ�;���ṹͼ���ش��������⣺

(1)������ѧ�ѵ�����ԭ�Ӻ����һ���ռ��˶�״̬��Ϊһ��ԭ�ӹ�������ӳ��ռ��˶�״̬�⣬����һ���˶�״̬����__________________��
(2)��̬��ԭ�ӵĺ�������Ų�ʽΪ_______________������ͬ���ڵ�p��Ԫ���е�һ�����ܴ������Ԫ����_______________ (��Ԫ�ط���)��
(3)�ۻƷ����У�Asԭ�ӵ��ӻ���ʽΪ_________________��
(4)�ۻƿɾ�������������Ӧ���ɴƻƣ�

�ٷ�Ӧ��Ļ�ѧ����ʽΪ________________________��
��SO2������ԭ�ӵ�VSEPR����Ϊ______________________��
��������������Ԫ���ᣬ���ԣ�H3AsO3________HNO2(�>����<��)����������ʽṹ��֪ʶ����ԭ��____________________________��
(5)��ͼ3����Li��Fe��As����Ԫ����ɵij����廯����ľ���ṹ(�þ���������������Li�ھ����ڲ�)���þ���Ļ�ѧʽΪ_____________________��
����1��ԭ�ӵ�����Ϊ(0��0��0)��2��ԭ�ӵ�����Ϊ(1/4��1/4��1/3)����3��ԭ�ӵ�����Ϊ___________��
����֪�þ���������=0.53nm�������ӵ�������ֵΪNA����þ�����ܶ�Ϊ_______g��cm-3(�г�����ʽ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ��(��ȥ���ּг������������Լ�����)������������ƾ���(Na2S2O3��5H2O)��ʵ�鲽��������װ�âٵ���ƿ�еμ�80%��ŨH2SO4����ַ�Ӧ�����װ�â��л�����Һ���ᾧ���õ���Ʒ��
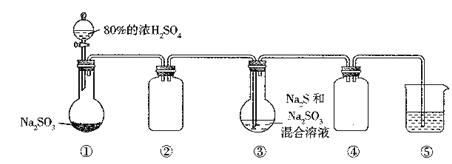
��֪:2Na2S+Na2SO3+3SO2=3Na2S2O3�������жϲ���ȷ����
A. Ӧ��װ�â٣�����H2O2��MnO2����ȡ����O2
B. ʵ������У�װ�âں�װ������������ͬ
C. װ�â��Т�Na2S��Na2SO3���������֮�����Ϊ1:2
D. װ�â���ʢ��NaOH��Һ�������ն����β��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������OH-��H+ =H2O��ʾ�Ļ�ѧ����ʽ��
A.̼��������Һ������������Һ��Ӧ
B.����������ϡ���ᷴӦ
C.����������Һ��ϡ���ᷴӦ
D.����������Һ��ϡ���ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ǵĽ���ϢϢ��أ�Ŀ�ҹ�ͨ�����6����Ⱦ�������Ũ���������������ָ����AQI����SO2��NO2����CO������3���е���Ⱦ�
��1������3������ֱ������������������������������ѧʽ����
��2�����������г�����NaClO2��Һ��Ϊ���ռ�����ͬʱ����������������������������ӦClO2��+2SO32��2SO42��+Cl�� �� �÷�Ӧ��ƽ�ⳣ��K�ı���ʽΪ��
��3�����÷�Ӧ6NO2+8NH3�T7N2+12H2O���ɵ�صķ���������ʵ����Ч��������������ŷţ����ỷ����Ⱦ�����ܳ�����û�ѧ�ܣ�װ����ͼ��ʾ��д���缫A�ĵ缫����ʽ �� ���������4.48L������ʱ��ͨ���缫B�ĵ�����Ϊ �� 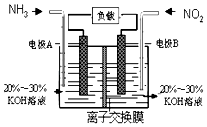
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com