
分析 ①Na2O2与H2O的反应生成氢氧化钠和氧气;
②Na2CO3溶液中通足量的CO2生成碳酸氢钠;
③Al 和NaOH溶液反应生成偏铝酸钠和氢气;
④Al2O3和NaOH反应生成偏铝酸钠和水;
⑤往AlCl3中加过量NaOH溶液生成偏铝酸钠和氯化钠;
⑥往AlCl3中逐滴的滴加氨水生成氢氧化铝和氯化铵;
⑦往NaAlO2中通入过量的二氧化碳氢氧化铝沉淀和碳酸氢钠.
解答 解:①Na2O2与H2O的反应生成氢氧化钠和氧气,离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑;
②Na2CO3溶液中通足量的CO2生成碳酸氢钠,离子方程式为CO32-+CO2+H2O=2HCO3-;
③Al 和NaOH溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
④Al2O3和NaOH反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-=2AlO2-+2H2O;
⑤往AlCl3中加过量NaOH溶液生成偏铝酸钠和氯化钠,离子方程式为Al3++4OH-=AlO2-+2H2O;
⑥往AlCl3中逐滴的滴加氨水生成氢氧化铝和氯化铵,离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
⑦往NaAlO2中通入过量的二氧化碳氢氧化铝沉淀和碳酸氢钠,离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
故答案为2Na2O2+2H2O=4Na++4OH-+O2↑;CO32-+CO2+H2O=2HCO3-;2Al+2OH-+2H2O=2AlO2-+3H2↑;Al2O3+2OH-=2AlO2-+2H2O;Al3++4OH-=AlO2-+2H2O;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
点评 本题考查离子方程式的书写,为高频考点,明确离子性质及离子之间反应是解本题关键,知道离子方程式书写规则,注意氢氧化铝和氧化铝的两性,注意氢氧化铝不溶于弱碱溶液,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
| 色态 | 溶于碱 | 超过1kPa受热 或遇光 | |
| 常温气体 | -59-11℃红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

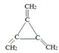 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 定样品中Na2O2的含量.
定样品中Na2O2的含量.
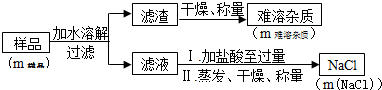
| m样品 | m难溶杂质 | m(NaCl) |
| 8.00g | 0.42g | 10.53g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2与O3 | B. | CH≡CH与CH2=CH2 | ||
| C. | ${\;}_{8}^{16}$O与${\;}_{8}^{18}$O | D. | CH3-CH2-CH2-CH3与CH3-CH2-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol•L-1的CuCl2溶液中含Cu2+为0.1NA | |
| B. | 标准状况下,22.4 L CCl4含CCl4分子为NA | |
| C. | 1mol H3O+含质子数为10 NA | |
| D. | 1mol Na2O2混合物中含阴离子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验必需仪器有滴定管、锥形瓶、滴定管夹架台 | |
| B. | 若选择甲基橙作指示剂,则测得食醋中CH3COOH浓度偏高 | |
| C. | 滴定之前的操作是选滴管、检漏、水洗、润洗、装液、调液面、读数 | |
| D. | 开始俯视读数,终点时仰视读数,测得食醋中CH3COOH浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何气体单质在标准状况下体积约为22.4L,则含有2NA个原子 | |
| B. | 常温常压下,16g氧气和32 g臭氧(O3)所含氧原子总数为3NA | |
| C. | 常温常压下,11.2L甲烷中含有的氢原子数为2NA | |
| D. | 标准状况下,0.3mol二氧化碳中含有氧原子数0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| B. | 用硫酸铜溶液吸收硫化氢气体:Cu2++S2-═CuS↓ | |
| C. | 稀硝酸中加入过量铁粉:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| D. | 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++HCO3-+OH-═BaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com