
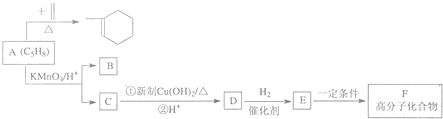
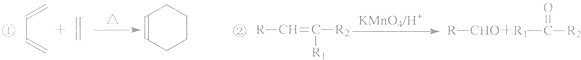
 时,A发生的反应类型为
时,A发生的反应类型为 ,A发生信息②中的氧化反应生成B与C,C能与新制氢氧化铜反应,D与氢气发生加成反应生成E,E能形成高分子化合物,则B为HCHO,C为O=C(CH3)CHO,D为O=C(CH3)COOH,E为HOCH(CH3)COOH,F为
,A发生信息②中的氧化反应生成B与C,C能与新制氢氧化铜反应,D与氢气发生加成反应生成E,E能形成高分子化合物,则B为HCHO,C为O=C(CH3)CHO,D为O=C(CH3)COOH,E为HOCH(CH3)COOH,F为 ,据此解答.
,据此解答.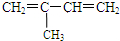 ,A发生信息②中的氧化反应生成B与C,C能与新制氢氧化铜反应,D与氢气发生加成反应生成E,E能形成高分子化合物,则B为HCHO,C为O=C(CH3)CHO,D为O=C(CH3)COOH,E为HOCH(CH3)COOH,F为
,A发生信息②中的氧化反应生成B与C,C能与新制氢氧化铜反应,D与氢气发生加成反应生成E,E能形成高分子化合物,则B为HCHO,C为O=C(CH3)CHO,D为O=C(CH3)COOH,E为HOCH(CH3)COOH,F为 ,
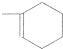
,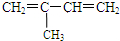 ,用系统命名法命名,A的名称为2-甲基-1,3-丁二烯,天然橡胶的结构简式为
,用系统命名法命名,A的名称为2-甲基-1,3-丁二烯,天然橡胶的结构简式为 ,
, ;
; 时发生反应类型为:加成反应,故答案为:加成反应;
时发生反应类型为:加成反应,故答案为:加成反应;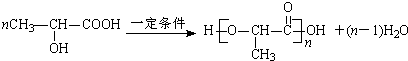 ,
,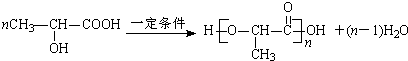 ;
;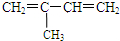 与Br2按物质的量之比1:1发生加成反应时,当发生1,2-加成时,生成物为:BrCH2C(Br)C(CH3)=CH2,CH2=CCBr(CH3)CH2Br,当生1,4-加成时,生成物为BrCH2C=C(CH3)CH2Br,存在顺反异构,故共有4种,故答案为:4;
与Br2按物质的量之比1:1发生加成反应时,当发生1,2-加成时,生成物为:BrCH2C(Br)C(CH3)=CH2,CH2=CCBr(CH3)CH2Br,当生1,4-加成时,生成物为BrCH2C=C(CH3)CH2Br,存在顺反异构,故共有4种,故答案为:4;

科目:高中化学 来源: 题型:
235 92 |
235 92 |
A、
| ||||||
B、可利用
| ||||||
C、利用化学反应把
| ||||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
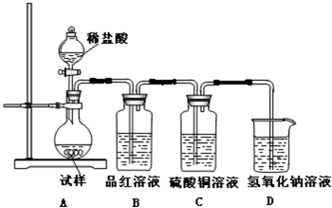
查看答案和解析>>
科目:高中化学 来源: 题型:
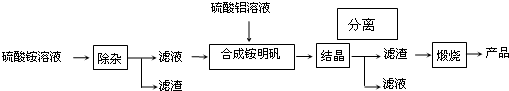
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
| Ksp | 8.8×10-36 | 2.2×10-20 | 5.48×10-16 | 3.2×10-19 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+ K+ HCO3- Cl- |
| B、NH4+ Mg2+ SO42- Cl- |
| C、K+ Na+ SO42- CH3COO- |
| D、K+ Ca2+ CO32- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
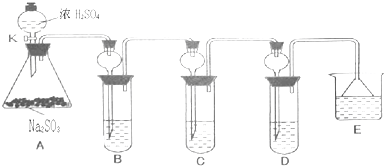
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com