
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
分析 (1)探究温度对化学反应速率的影响,应选择浓度相同条件下的实验;要探究浓度对化学反应速率的影响,应选择温度相同条件下的实验;
(2)影响反应速率的因素除了浓度、温度外,催化剂也影响反应速率;
根据反应方程式可知,反应产物中锰离子随着反应的进行,浓度变化较大,反应前加入硫酸锰,根据反应速率大小判断锰离子是否在该反应中起到催化作用.
解答 解:(1)探究温度对化学反应速率的影响,应选择浓度相同条件下的实验,所以应选择①⑤或②④;若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,温度相同条件下的实验,是探究浓度对化学反应速率的影响;
故答案为:①⑤或②④;不同反应物浓度;
(2)对化学反应速率影响最快的是催化剂,故猜想还可能是催化剂的影响,
反应方程式2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑中,浓度变化较大的为锰离子,所以选择的可以做催化剂的试剂应该含有锰离子,故只有B正确,
故答案为:Mn2+的催化作用;B.
点评 本题考查化学反应速率的影响因素,题目难度中等,影响化学反应速率的外界条件除温度、浓度、压强、催化剂外,还有很多因素可以改变反应速率,如光辐射、超声波、电弧、激光、强磁场、反应物颗粒大小等,探究单一条件对速率的影响时,要让此条件成为唯一变量.


科目:高中化学 来源: 题型:解答题
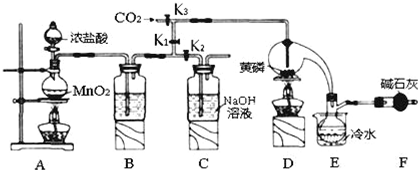
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X>W | |
| B. | Z单质在过量的X单质中燃烧生成ZX3 | |
| C. | 元素Y和W能形成离子化合物 | |
| D. | 元素W、X各自最高和最低化合价的代数和分别为0、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
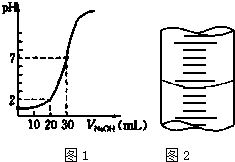 用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:
用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试管1 | 试管2 | |
| 实验现象 | 褪色很快 | 褪色很慢 |
| 褪色时间/s | 4秒 | 31秒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 金属质量/g | 金属 状态 | c(H2SO4) /mol/L | V(H2SO4)/mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.24 | 丝 | 0.5 | 100 | 20 | 34 | 500 |
| 2 | 0.24 | 粉末 | 0.5 | 100 | 20 | 35 | 50 |
| 3 | 0.24 | 丝 | 0.7 | 100 | 20 | 36 | 250 |
| 4 | 0.24 | 丝 | 0.8 | 100 | 20 | 35 | 200 |
| 5 | 0.24 | 粉末 | 0.8 | 100 | 20 | 36 | 25 |
| 6 | 0.24 | 丝 | 1.0 | 100 | 20 | 35 | 125 |
| 7 | 0.24 | 丝 | 1.0 | 100 | 35 | 50 | 50 |
| 8 | 0.24 | 丝 | 1.1 | 100 | 20 | 34 | 100 |
| 9 | 0.24 | 丝 | 1.1 | 100 | 30 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
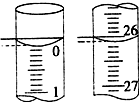 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mol | B. | 11 mol | C. | 12 mol | D. | 13 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com