
【题目】学生将一小块金属钾投入滴有酚酞的水中,这种操作能证明下述四点性质中的( )
①钾比水轻;②钾的熔点较低;③钾与水反应时要放出热量;④钾与水反应后溶液显碱性
A. 仅①④B. 仅④C. 除②外D. 全部
科目:高中化学 来源: 题型:
【题目】镁带在盐酸中反成,产生H2的速率(v)与时间(t)的关系如下图所示。
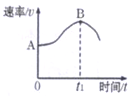
(1)写出该反应的离子方程式____________________。
(2)下列变化:①H+的浓度②镁带的表面积③溶液的温度④Cl-的浓度,不能影响该反应速率的有_________(填写选项的序号)。
(3)0~t1,时间段速率逐渐加快的主要原因是___________。
(4)t1时刻后反应速率变慢的主要原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.室温下,已知Ksp[Mg(OH)2]=1.0×10-11,现用MgSO4溶液制备[Mg(OH)2。若MgSO4溶液中c(Mg2+)=1.0×10-3mol/L,那么,向其中加入等体积的KOH溶液的浓度为________mol/L,可使Mg2+恰好完全沉淀(溶液体积变化可忽略不计,但溶液中残留的Mg2+不能忽略)。
Ⅱ.钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

(1)钼和锆同属过渡金属, 锆还是核反应堆燃料棒的包裹材料, 锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷。下列关于锆合金、二氧化锆的说法中正确的是_____(填序号)
a.锆合金比纯锆的熔点高,硬度小
b.二氧化锆陶瓷属于新型无机非金属材料
c.将一束光线通过纳米级二氧化锆会产生一条光亮的通路
(2)途径I碱浸时发生反应的化学反应方程式为_________________
途径Ⅱ氧化时发生反应的离子方程式为______________________
(3)分析纯的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是______________。
(4)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为____。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能通过一步反应直接完成的是( )
A. Al→Al3+ B. Al→ [Al(OH)4]-
C. Al2O3 →Al(OH)3 D. Al2O3 →[Al(OH)4]-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是____(填元素符号),其中C原子的核外电子排布式为______________;
(2)单质A有两种同素异形体,其中沸点高的是___________(填分子式),原因是_________________;A和B的氢化物所属的晶体类型分为______________和______________;
(3)C和D反应可生成组成比1:3的化合物E,E的立体构型为________________,中心原子的杂化轨道类型___________________;
(4)化合物D2A的立体构型为______________,中心原子的价层电子对数为_______________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____________________;
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_________,晶胞中A原子的配位数为__________,列式计算晶体F的密度_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO4晶体易溶于水,它溶于水时,电离出三种不同的离子,电离方程式为:NaHSO4===Na+ + H+ + SO42-,因此NaHSO4溶液显酸性。但NaHSO4受热熔化时却只能电离出两种不同离子。
(1)NaHSO4在熔融状态下的电离方程式是________________。
(2)下列说法中正确的是________(填序号)。
A.NaHSO4属于酸 B.NaHSO4属于氢化物
C.NaHSO4晶体属于电解质 D.NaHSO4溶液能与Zn反应生成氢气
(3)向一定量的Ba(OH)2溶液中,逐滴加入NaHSO4溶液,直至不再生成沉淀,该过程中发生反应的离子方程式为:_________________________________________,沉淀完全后,继续滴加NaHSO4溶液,此时发生反应的离子方程式为:_____________。
(4)NaHSO4和NaHCO3中都含有氢元素,但将二者同时加入水中,可以发生化学反应,该反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料。其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂。A可发生如图所示的一系列化学反应,其中①、②、③属于同种反应类型。请回答下列问题:
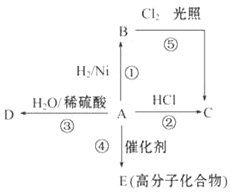
(1)写出A、B、C、D的结构简式:A____________、B___________、C__________、D_________。
(2)写出②、⑤两步反应的化学方程式,并注明反应类型:
② ______________________________________,反应类型:__________________________。
⑤ ______________________________________,反应类型:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合理膳食,保持营养均衡,是青少年学生健康成长的重要保证。秋葵是一种大众喜爱的食材,含有蛋白质、维生素A、维生素C、纤维素、阿拉伯果糖和丰富的铁、锌、钙等元素,根据上述内容回答下列问题:
①蛋白质在人体内最终的水解产物是_________________。
②属于人体所需微量元素的是____________________。
③属于脂溶性维生素的是_________________。
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
①硅酸盐产品在生活中使用广泛,下列不是硅酸盐产品的是 _______________。
A、水泥 B、陶瓷 C、玻璃 D、塑料
②玻璃是重要的硅酸盐产品。生产玻璃时,石灰石与石英反应的化学方程式为______。
(3)保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。
①pH<_________________的雨水称为酸雨;向煤中加入适量的__________________,可以大大减少燃物产物中SO2的量。
②天然水中杂质较多,常需加入明矾、ClO2等物质处理后才能饮用。加入ClO2的作用是
__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com