
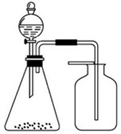
| A. | 浓氨水与固体CaO | B. | 稀盐酸与石灰石 | C. | 稀硝酸与铜片 | D. | 浓盐酸与MnO2 |
科目:高中化学 来源: 题型:选择题
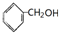
| A. | ①③④ | B. | ②④ | C. | ①③⑤ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: |
| I1=738kJ•mol-1 I2=1 451kJ•mol-1 I3=7 733kJ•mol-1 I4=10 540kJ•mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
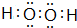 (用电子式表示).
(用电子式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
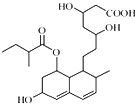 普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )| A. | 能与FeCl3 溶液发生显色反应 | |
| B. | 能使酸性KMnO4 溶液褪色 | |
| C. | 能发生加成、取代,不能消去反应 | |
| D. | 1 mol 该物质最多可与1 mol NaOH 反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
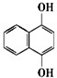 A苯环上的n溴代物的同分异构体的数目和m溴代物的同分异构体的数目相等,则n和m一定满足的关系式是( )
A苯环上的n溴代物的同分异构体的数目和m溴代物的同分异构体的数目相等,则n和m一定满足的关系式是( )| A. | 2n=m | B. | n=m | C. | n+m=6 | D. | n+m=8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着原子序数的递增,第三周期元素的电负性逐渐减小 | |
| B. | 铝的第一电离能比镁的第一电离能大 | |
| C. | K、Na、Li的第一电离能逐渐增大 | |
| D. | 电负性差值大的元素原子之间形成的化学键主要是共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
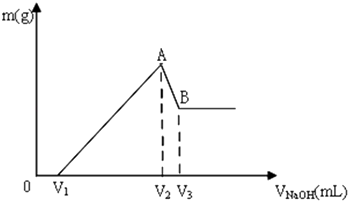
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐和金属钠的熔化 | B. | 氯化铵和单质硫的熔化 | ||
| C. | 碘和干冰的升华 | D. | 金刚石和石灰石的熔化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com