
| A. | 将pH均为a的NaOH溶液和氨水分别加水稀释100倍,pH分别变为b和c,则a、b、c的大小关系为b>c>a | |
| B. | 常温下0.1 mol•L-1 KHA溶液的pH=3,则该溶液中C(A2- )<c(H2A) | |
| C. | 室温时 M(OH)2(s)?M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b mol•L-1 时,溶液的pH为14+$\frac{1}{2}$1g$\frac{a}{b}$ | |
| D. | 0.1 mol•L-1Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) |
分析 A.氢氧化钠溶液和氨水具有相同的pH,由于氢氧化钠是强电解质,则在稀释时强碱的变化程度大,加水稀释促进一水合氨电离;
B.常温下0.1 mol•L-1 KHA溶液的pH=3,溶液显酸性说明HA-电离大于HA-离子水解;
C.先根据该难溶物的溶度积及c(M2+)计算出该溶液中氢氧根离子浓度,然后根据c(H+)=$\frac{1{0}^{-14}}{c(O{H}^{-})}$及pH=-lgc(H+)计算出该溶液在常温下pH;
D.0.1 mol•L-1Na2CO3溶液中存在质子守恒,水电离出氢氧根离子浓度等于水电离出所有氢离子浓度总和.
解答 解:A.加水稀释氢氧化钠溶液和氨水中c(OH-)都变小,加水稀释促进一水合氨电离,则稀释后氨水的pH大于氢氧化钠,则a、b、c的大小关系是:a>c>b,故A错误;
B.常温下0.1 mol•L-1 KHA溶液的pH=3,溶液显酸性说明HA-电离大于HA-离子水解,c(A2- )>c(H2A),故B错误;
C.Ksp=c(M2+)×c2(OH-)=a,则c(OH-)=$\sqrt{\frac{Ksp}{c({M}^{2+})}}$=$\sqrt{\frac{a}{b}}$mol/L,
常温下氢离子浓度为:c(H+)=$\frac{1×1{0}^{-14}}{c(O{H}^{-})}$,
则该溶液的pH=-lgc(H+)=-lg$\frac{1×1{0}^{-14}}{c(O{H}^{-})}$=-lg$\frac{1×1{0}^{-14}}{\sqrt{\frac{a}{b}}}$=14+$\frac{1}{2}$lg$\frac{a}{b}$,故C正确;
D.0.1 mol•L-1Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故D错误;
故选C.
点评 本题考查学生弱电解质的电离平衡以及盐的水解、难溶物溶度积的计算、溶液pH的计算等方面的知识,属于综合知识的考查,题目难度中等,注意盐的类型和溶液酸碱性关系,电解质溶液中质子守恒判断.


科目:高中化学 来源: 题型:解答题
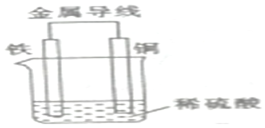 现有反应:①Ba(OH)2•8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+H2↑.试回答下列问题:
现有反应:①Ba(OH)2•8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+H2↑.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
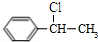 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$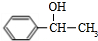 +NaCl;
+NaCl;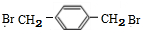 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8×l0-7mol/L | B. | 1.0×l0-5mol/L | C. | 1.0×l0-7mol/L | D. | 1.8×l0-9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子从电极a经电解质溶液流向电极b | |
| B. | 电池放电时Na+从b极区移向a极区 | |
| C. | 放电一段时间后,正极消耗的OH-和负极生成的OH-的量相等 | |
| D. | 电池的负极反应为BH4--8e-+8OH-=BO2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 证明某红棕色气体是溴蒸气还是NO2,可用湿润的淀粉一KI试纸检验,观察试纸颜色的变化 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的SO2完全反应,则同温同压下,逸出气体和SO2的体积比为2:3 | |
| C. | 验证淀粉水解产物是否具有还原性,取水解液于试管中加入新制氢氧化铜悬浊液,加热煮沸,观察是否出现砖红色沉淀 | |
| D. | 在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,该过程中总反应为2A1+3Ag2S═6Ag+Al2S3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
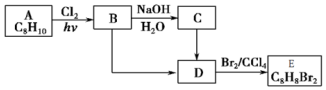
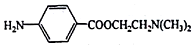 )可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件己省略):
)可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件己省略):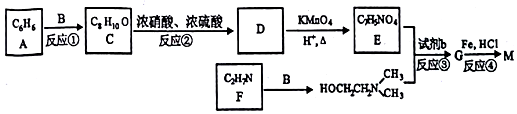
 的结构不稳定.
的结构不稳定.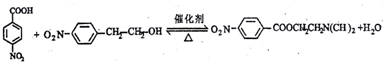 .
.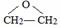 、FH3C-NH-CH3.
、FH3C-NH-CH3.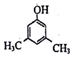 、
、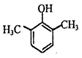 、
、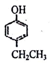 .
.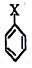 ,若-X为烃基或羟基,再次取代时,新取代基在-X的邻位或对位;若-X为羧基或硝基,再次取代时,新取代基在-X的间位.参照上述合成路线,设计由甲苯合成
,若-X为烃基或羟基,再次取代时,新取代基在-X的邻位或对位;若-X为羧基或硝基,再次取代时,新取代基在-X的间位.参照上述合成路线,设计由甲苯合成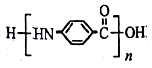 的合成路线(用合成路线流程图表示,并注明反应条件,合成过程中无机试剂可任选).
的合成路线(用合成路线流程图表示,并注明反应条件,合成过程中无机试剂可任选). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
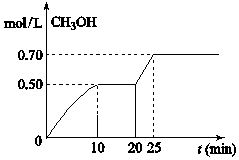 在容积固定为2L的密闭容器中,充入2molCO2和6molH2,在温度500℃时发生反应,CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,CH3OH的浓度随时间变化如右图,下列说法正确的是( )
在容积固定为2L的密闭容器中,充入2molCO2和6molH2,在温度500℃时发生反应,CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,CH3OH的浓度随时间变化如右图,下列说法正确的是( )| A. | 从开始到25分钟,CO2的转化率是35% | |
| B. | 从20分钟到25分钟,可能是缩小容器体积 | |
| C. | 其它条件不变,将温度升到800℃,平衡常数增大 | |
| D. | 从反应开始到10分钟,H2的平均反应速率v(H2)=0.15mol(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com