
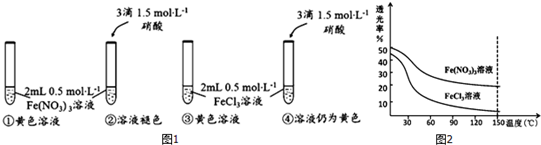
分析 (1)根据信息:①硝酸铁中存在:[Fe(H2O)6]3++H2O?[Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+来判断;
(2)氯化铁中存在的[FeCl4(H2O)2]-为黄色;
(3)溶液的透光率和溶液中有颜色的离子的浓度大小之间有关系,根据温度对化学平衡移动的影响知识来回答;
(4)FeCl3溶液中存在:[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O,据平衡移动原理来回答;
(5)平衡[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O中,增加氯离子浓度,可以引起化学平衡的移动,据此回答.
解答 解:(1)根据信息:①硝酸铁中存在:[Fe(H2O)6]3++H2O?[Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+,Fe(NO3)3溶液呈黄色的原因是[Fe(H2O)6]3+水解产生了黄色的[Fe(H2O)6-n(OH)n]3-n,
故答案为:[Fe(H2O)6]3+水解产生了[Fe(H2O)6-n(OH)n]3-n;
(2)FeCl3溶液呈黄色主要是发生:[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O,由于含有[FeCl4(H2O)2]-的缘故,因为:试管②、④中加入等量的HNO3后,②中溶液褪色,而④中溶液仍呈黄色,
故答案为:[FeCl4(H2O)2]-;试管②、④中加入等量的HNO3后,②中溶液褪色,而④中溶液仍呈黄色;
(3)溶液的透光率和溶液中有颜色的离子的浓度大小之间有关系,温度升高,导致平衡[Fe(H2O)6]3++nH2O?[Fe(H2O)6-n(OH)n]3-n+nH3O+正向移动,[Fe(H2O)6-n(OH)n]3-n浓度增大,溶液颜色加深;
故答案为:温度升高,导致平衡[Fe(H2O)6]3++nH2O?[Fe(H2O)6-n(OH)n]3-n+nH3O+正向移动,[Fe(H2O)6-n(OH)n]3-n浓度增大,溶液颜色加深;
(4)FeCl3溶液中存在:[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O,温度升高,有色离子浓度增加程度大,说明该反应是吸热反应,FeCl3溶液透光率随温度升高而减小的幅度明显大于Fe(NO3)3溶液,
故答案为:[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O;吸热;
(5)平衡[Fe(H2O)6]3++4Cl-?[FeCl4(H2O)2]-+4H2O中,增加氯离子浓度,可以引起化学平衡正向移动,有色离子浓度增加,进而说明FeCl3溶液透光率随温度升高而减小的幅度明显大于Fe(NO3)3溶液,但是不能阴极铁离子,其铁离子的黄色会干扰实验结果,
故答案为:B.
点评 本题是一道关于化学平衡移动原理的应用知识的实验方案设计探究题,考查学生分析和解决问题的能力,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 二氯甲烷只有一种,说明甲烷分子是立体结构 | |
| B. | 2-丁烯四个碳原子共平面,说明乙烯分子是平面结构 | |
| C. | 苯乙炔分子中所有原子共平面,说明乙炔分子中原子在一条直线上 | |
| D. | 邻二甲苯只有一种,说明苯分子中不存在单双键交替的碳碳键. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液与K+、NO3-、OH-可以大量共存 | |
| B. | 该溶液显碱性的原因为ClO-+H2O?HClO+OH- | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3 BaSO4↓+2Al(OH)3↓ | |
| B. | 将少量CO2通入NaClO溶液中:ClO-+CO2+H2O═HCO3-+HClO (已知:次氯酸的Ka为2.95×10-8,碳酸的Ka2为5.6×10-11) | |
| C. | 次氯酸钙溶液中通入足量SO2:Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+ | |
| D. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
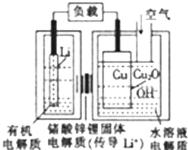 某锂电池的结构如图所示,该电池放电过程中的一个电极反应式为Cu2O+2e-+H2O=2Cu+2OH-,下列说法正确的是( )
某锂电池的结构如图所示,该电池放电过程中的一个电极反应式为Cu2O+2e-+H2O=2Cu+2OH-,下列说法正确的是( )| A. | 放电时,Li+透过固体电解质向Li极移动 | |
| B. | 放电时,负极的电极反应式为Li-e-+OH-=LiOH | |
| C. | 放电时,水溶液的pH不断升高 | |
| D. | 放电过程中需要不断地补充Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com