
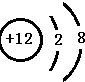 .
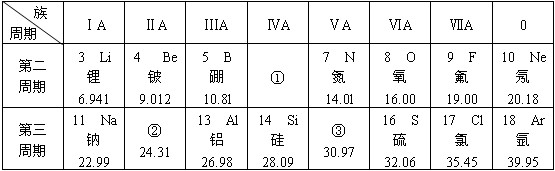
.分析 (1)短周期中Na的金属性最强,电子层越多原子半径越大,同周期原子序数大的原子半径小;
(2)相对原子质量为30.97的元素为P,位置①中的元素为C;
(3)位置②中元素为Mg,质子数为12,离子核外电子数为10;
(4)位置③中的元素形成的一种单质分子的空间结构为正四面体,单质为P4,含6个P-P共价键;
(5)第三周期中有一种非元素最高价氧化物对应的水化物难溶于水,但能溶于烧碱溶液,为硅酸.
解答 解:(1)金属性最强的是Na,电子层越多原子半径越大,同周期原子序数大的原子半径小,原子半径最小的是F,故答案为:Na;F;
(2)相对原子质量为30.97的元素为P,为非金属元素;位置①中的元素为C,其质子数为6,故答案为:非金属; 6;
(3)位置②中元素为Mg,质子数为12,离子核外电子数为10,离子结构示意图为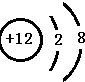 ,故答案为:
,故答案为: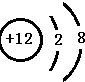 ;
;
(4)位置③中的元素形成的一种单质分子的空间结构为正四面体,单质为P4,含6个P-P共价键,为非极性共价键,1mol该分子中所含化学键个数为6NA(6×6.02×10-23),
故答案为:非极性共价键;6NA(6×6.02×10-23);
(5)第三周期中有一种非元素最高价氧化物对应的水化物难溶于水,但能溶于烧碱溶液,为硅酸,它溶于烧碱溶液的离子反应方程式为2OH-+H2SiO3=SiO32-+2H2O,
故答案为:2OH-+H2SiO3=SiO32-+2H2O.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素化合物知识等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
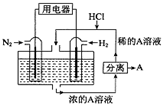 科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电源,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )
科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电源,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )| A. | 该电池外电路电流从通入H2的电流流向通入N2的电极 | |
| B. | 反应过程中溶液的pH会变大,故需要加入盐酸 | |
| C. | 通入N2的电极发生的电极反应式为:N2+6e-+8H+═2NH4+ | |
| D. | 通入H2的电极为负极,A为NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其氢氧化物中碱性最强的是NaOH | B. | 单质还原能力最强的是钠 | ||
| C. | 单质的与水反应时钠最剧烈 | D. | 原子半径逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加NaI溶液可以得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
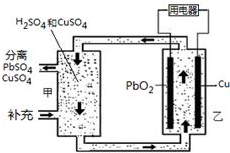 流动电池可以在电池外部调节电解质溶液,从而维持电池内部电解质溶液浓度稳定,原理如图.下列说法错误的是( )
流动电池可以在电池外部调节电解质溶液,从而维持电池内部电解质溶液浓度稳定,原理如图.下列说法错误的是( )| A. | Cu为负极 | |
| B. | PbO2电极的电极反应式为:PbO2+4H++SO42-+2e-=PbSO4+2H2O | |
| C. | 甲中应补充硫酸 | |
| D. | 当消耗1 mol PbO2,需分离出2 mol CuSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com