
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
利用差量法计算消耗HCl物质的量,再根据v=$\frac{△c}{△t}$计算v(HCl);
(2)a.未指明正逆速率,不能确定是否到达平衡;
b.不同物质表示正逆速率之比等于化学计量数之比,反应到达平衡;
c.增大没有反应物难度,平衡正向氧气,其它反应物转化率增大;
d.分离出H2O,平衡正向移动,正反应速率减小至平衡状态.
解答 解:(1)4HCl+O2$\frac{\underline{\;CuO/CuCl\;}}{400℃}$2Cl2+2H2O的平衡常数表达式K=$\frac{{c}^{2}(C{l}_{2})×{c}^{2}({H}_{2}O)}{{c}^{4}(HCl)×c({O}_{2})}$;
4min后达到平衡,测得容器内物质由2.0mol减少至1.75mol,则:
4HCl+O2$\frac{\underline{\;CuO/CuCl\;}}{400℃}$2Cl2+2H2O 物质的量减小
4 1
1mol 2mol-1.75mol=0.25mol
故v=$\frac{\frac{1mol}{4L}}{4min}$=0.0625mol/(L?min),
故答案为:$\frac{{c}^{2}(C{l}_{2})×{c}^{2}({H}_{2}O)}{{c}^{4}(HCl)×c({O}_{2})}$;0.0625mol/(L?min);
(2)a.未指明正逆速率,不能确定是否到达平衡,若分别表示正逆速率,则处于平衡状态,故a错误;
b.4v正(HCl)=v逆(O2)均表示逆反应速率,反应始终按该比例关系进行,故b错误;
c.又加入1molO2,氧气浓度增大,平衡正向移动,HCl的转化率增大,故c正确;
d.分离出H2O,平衡正向移动,正反应速率减小至平衡状态,达新平衡时,v正(HCl)减小,故d错误,
故选:c.
点评 本题考查化学平衡计算与影响因素、平衡常数、反应速率计算、平衡状态判断等,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.


科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂 | 提纯方法 |
| A | 苯 | 溴水 | 乙醇 | 分液 |
| B | 甲烷 | 乙烯 | 酸性高锰酸钾溶液 | 洗气 |
| C | 溴苯 | 溴 | 稀氢氧化钠溶液 | 混和振荡、静置分液 |
| D | 苯 | 苯酚 | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H++2e-═H2↑ | B. | 2H2O+O2+4e-═4OH- | ||
| C. | Fe-3e═Fe3+ | D. | Fe-2e═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol金属钠含有的电子数 | |
| B. | 1 L 1 mol/L硫酸溶液所含的H+数 | |
| C. | 标准状况下,22.4 L四氯化碳所含的分子数 | |
| D. | 0.012 kg 12C所含的原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A. | 该反应的△H>0 | |
| B. | 加压、增大H2浓度和加入催化剂都能提高CO的转化率 | |
| C. | 工业上采用5×103kPa和 250℃的条件,其原因是原料气的转化率高 | |
| D. | t℃时,向 1 L密闭容器中投入0.1 mol CO和0.2 mol H2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.74 | 0.75 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| C. | 元素R的氧化物对应的水化物一定为强酸 | |
| D. | 由X形成的化合物XY2和XR4,其中XR4的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | ⅠA | ⅡA | ⅢA | ⅠVA | VA | VⅠA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
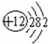 ,⑧
,⑧ ;
; .最不活泼的元素是Ar.(以上均填元素名称)
.最不活泼的元素是Ar.(以上均填元素名称)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com