
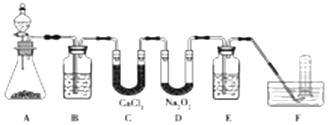
分析 实验装置可知,本实验首先由CaCO3和盐酸反应生成CO2,产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后通过氯化钙固体进行干燥,再通过过氧化钠,过氧化钠与CO2反应,产生O2,再氢氧化钠吸收氧气未反应的二氧化碳,最后用排水法收集O2,过氧化钠样品的纯度测定,是利用过氧化钠与水反应生成氢氧化钠,再用盐酸滴定氢氧化钠,根据盐酸的量可以计算出原样品中过氧化钠的量,在实验过程中由于过氧化钠与水反应有过氧化氢生成,所以要用热水使过氧化氢分解,以减少对指示剂的影响,据此答题.
解答 解:实验装置可知,本实验首先由CaCO3和盐酸反应生成CO2,产生气体通过饱和NaHCO3溶液,以除去CO2气体中混入的HCl,然后通过氯化钙固体进行干燥,再通过过氧化钠,过氧化钠与CO2反应,产生O2,再氢氧化钠吸收氧气未反应的二氧化碳,最后用排水法收集O2,过氧化钠样品的纯度测定,是利用过氧化钠与水反应生成氢氧化钠,再用盐酸滴定氢氧化钠,根据盐酸的量可以计算出原样品中过氧化钠的量,在实验过程中由于过氧化钠与水反应有过氧化氢生成,所以要用热水使过氧化氢分解,以减少对指示剂的影响,
(1)A是实验室制取CO2的装置,用碳酸钙与盐酸反应,反应的离子方程式是CaCO3+2H+=Ca2++H2O+CO2↑,根据上面的分析可知,装置B的作用是除去CO2中混有的HCl,装置C的作用是干燥CO2,装置E装的试剂是 NaOH溶液,
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;除去CO2中混有的HCl;干燥CO2;NaOH溶液;
(2)过氧化钠作潜水艇供氧剂的化学反应方程为2Na2O2+2CO2=2Na2CO3+O2↑,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)①过氧化钠样品的纯度测定步骤中,趁热加入样品溶解,因为沸水能使Na2O2溶解时所生成的H2O2迅速分解,消除其对中和滴定(特别是指示剂)的影响,
故答案为:沸水能使Na2O2溶解时所生成的H2O2迅速分解,消除其对中和滴定(特别是指示剂)的影响;
②根据题意,滴定中消耗的盐酸的物质的量为cV×10-3 mol,即溶液中氢氧化钠的物质的量为cV×10-3 mol,根据钠元素守恒可知,原样品中过氧化钠样质量为$\frac{1}{2}×$cV×10-3 mol×78g/mol=39cV×10-3 g,所以样品的纯度是$\frac{39cV×10{\;}^{-3}g}{ag}$×100%=$\frac{3.9cV}{a}$%,
故答案为:$\frac{3.9cV}{a}$%.
点评 本题考查了物质性质实验方案的设计,题目难度中等,明确过氧化钠与水反应的实质为解答关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学计算、化学实验能力.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.85gNaCl晶体中含有0.1 NA 个Na+ | |
| B. | 1molFeCl3 完全水解转化为Fe(OH)3胶体后能生成NA个胶体粒子 | |
| C. | 过量的Zn与含1molH2SO4的稀H2SO4完全反应,转移的电子数一定为2NA | |
| D. | 一定量的Fe 与含1molHNO3的稀HNO3恰好完全反应,被还原的氮原子数小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 、
、 .
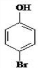
. 是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境.
是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境.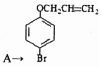 的有机反应类型取代反应.
的有机反应类型取代反应. .
.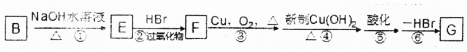
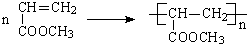 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| B. | 用食醋除去水壶内的水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | KHCO3与足量澄清石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:Mn2++ClO-+H2O═MnO2↓+Cl-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
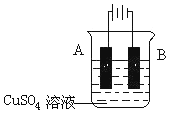 钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.
钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
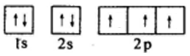 ,D的电子排布式为1s22s22p63s23p2.
,D的电子排布式为1s22s22p63s23p2. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com