
 ,故答案为:H;氮;
,故答案为:H;氮; ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 一定条件下密闭容器中发生如图反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)反应过程中能量变化如图所示,下列说法正确的是( )
一定条件下密闭容器中发生如图反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)反应过程中能量变化如图所示,下列说法正确的是( )| A、降低温度可以加快正反应速率 |
| B、反应体系中加入催化剂可增加反应热 |
| C、降低温度可以提高NH3的转化率 |
| D、增加空气的量可以提高混合气体中NO的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
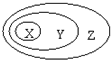 下表中所示物质或概念间的从属关系符合如图的是
下表中所示物质或概念间的从属关系符合如图的是| X | Y | Z | |
| A | 钠元素 | 主族元素 | 短周期元素 |
| B | 电解质 | 化合物 | 纯净物 |
| C | 氢氧化铁 | 胶体 | 分散系 |
| D | 置换反应 | 氧化还原反应 | 放热反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、沉淀转化反应2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol?L-1 |
| B、约有2×10-5mol AgCl溶解 |
| C、反应后溶液中的:c(Na+)>c (Cl-)>c (CO32-)>c (OH-)>c (H+) |
| D、反应后溶液中的:c(Na+)+c (H+)+c (Ag+)=2 c (CO32-)+c (HCO3-)+c (Cl-)+c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH/H2O |
| NaOH/醇 |
| 加热 |
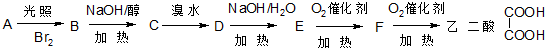
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com