
分析 A.含有塞子或活塞的仪器在使用前必须检验是否漏水;
B.分液时,上层液体从上口倒出,下层液体从下口倒出;
C.酒精和水互溶;
D.粉碎可以增大与溶剂的接触面积,振荡、搅拌可以改变固体周围的饱和状态,加速溶解;加热可以增大分子的移动速率;
E.将玻璃管插入带孔橡皮塞前,把玻璃管要插入的一端用水湿润,否则不易插入;
F.浓硫酸、NaOH都具有强腐蚀性;
F.蒸发操作中注意防止局部过热而造成液滴飞溅;
G.量筒不能作为稀释仪器.
解答 解:A.含有塞子或活塞的仪器在使用前必须检验是否漏水,所以使用分液漏斗前要检查活塞处、塞子处是否漏水,故错误;
B.分液时,上层液体从上口倒出,下层液体从下口倒出,否则易产生杂质,故正确;
C.酒精和水互溶,所以不能用酒精作碘水的萃取剂,故错误;
D.粉碎可以增大与溶剂的接触面积,搅拌可以改变固体周围的饱和状态,加速溶解,在试管内进行少量固体溶解可以用振荡,在烧杯内进行较多固体溶解可以用搅拌,加热可以增大分子的移动速率,可以加速固体的溶解,故正确;
E.将玻璃管插入带孔橡皮塞前,把玻璃管要插入的一端用水湿润,否则不易插入,故正确;
F.浓硫酸和NaOH溶液都具有强腐蚀性,不慎将少量浓H2SO4溶液沾到皮肤上,应该先用抹布拭去,然后用大量水冲洗,最后涂上稀的碳酸氢钠溶液,故错误;
F.蒸发操作中为防止局部过热而造成液滴飞溅,应该用玻璃棒搅拌,故G正确;
G.量筒不能作为稀释仪器,只能量取一定体积的液体,故错误.
故选BDEG.
点评 本题考查化学实验方案评价,为高频考点,涉及实验基本操作、仪器实验方法、元素化合物性质等知识点,明确实验原理、实验基本操作规范性及物质性质特性是解本题关键,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:推断题
 A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:
A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
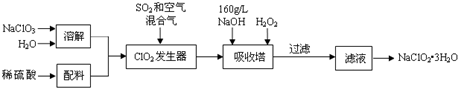
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.062 mol/L | B. | 0.62 mol/L | C. | 6.2mol/L | D. | 62mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
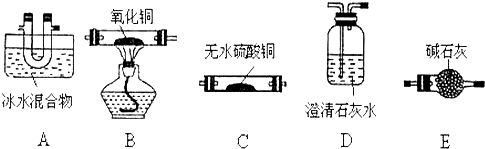
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4升氧气中一定含有阿伏加德罗常数个氧分子 | |
| B. | 1摩氧气的质量是32克 | |
| C. | 1摩氧气与1摩二氧化碳中的原子个数相等 | |
| D. | H2SO4的摩尔质量是98克 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发新的能源 | B. | 合成新的物质 | ||
| C. | 研究物体运动规律 | D. | 防治环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com